
目录
⊙辉瑞:JAK1抑制剂阿布昔替尼片获批上市
⊙复宏汉霖:PD1单抗斯鲁利报第3项适应症
⊙博生吉医药:TAA06注射液递交IND
⊙ 科伦博泰:STING激动剂KL340399报IND,两款新药获批临床
辉瑞:JAK1抑制剂阿布昔替尼片获批上市
据NMPA官网最新消息,辉瑞公司的1类创新药阿布昔替尼片获批在国内上市,适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。

截图来源:NMPA官网
近日,国家药品监督管理局通过优先审评审批程序批准辉瑞公司申报的1类创新药阿布昔替尼片(商品名:希必可/CIBINQO)上市。该药适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的难治性、中重度特应性皮炎成人患者。
阿布昔替尼是Janus激酶(JAK)1抑制剂。JAK是一种细胞内酶,介导细胞膜上的细胞因子或生长因子受体相互作用而产生的信号传导,从而影响细胞造血功能和免疫细胞功能。阿布昔替尼通过阻断三磷酸腺苷(ATP)结合位点可逆性和选择性地抑制JAK1。该药品的上市为特应性皮炎患者提供了新的治疗选择。
复宏汉霖:PD-1单抗报新适应症上市申请
4月11日,中国国家药监局药品审评中心(CDE)官网公示,复宏汉霖提交了其PD1单抗斯鲁利单抗(HLX10)注射液新适应症上市申请,并获受理。这是该药在中国递交的第三项上市申请。
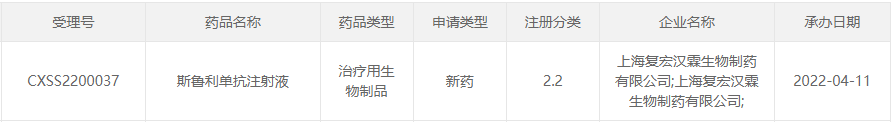
截图来源:CDE官网
上月,斯鲁利单抗注射液的首个适应症上市申请已获得NMPA批准,成为在国内上市的第13款PD-1/PD-L1类药物。2021年9月,复宏汉霖递交抗PD-1单抗斯鲁利单抗注射液的第2项适应症(鳞状非小细胞肺癌一线治疗)上市申请,并获得受理。
据新闻稿,斯鲁利单抗(HLX10)是复宏汉霖开发的创新型抗PD-1单抗,有望单药或与其他产品开展免疫联合疗法广泛用于实体瘤的治疗。斯鲁利单抗在标准治疗失败的MSI-H实体瘤患者中展现了显著的抗肿瘤活性,且具有较好的安全性和耐受性。
经药融云查询,斯鲁利单抗在国内的肝癌、直肠癌、宫颈癌、乳腺癌、胃癌等高发癌种已进入III期临床试验。
斯鲁利单抗在国内的III期临床试验

截图来源:药融云临床试验数据库
博生吉医药:TAA06注射液递交IND
据CDE官网,博生吉医药的1类生物药TAA06注射液临床申请获CDE受理。

截图来源:CDE官网
据公开信息,TAA06注射液为博生吉医药开发的靶向B7-H3的嵌合抗原受体(CAR)-T细胞注射液,拟用于治疗神经母细胞瘤。在临床前研究中,该候选药已取得了良好的药效学和安全性数据。3月中旬获得美国FDA授予的孤儿药资格,用于治疗神经母细胞瘤。
科伦博泰:STING激动剂KL340399报IND
据CDE官网,四川科伦博泰生物的KL340399注射液再次递交IND并获受理。
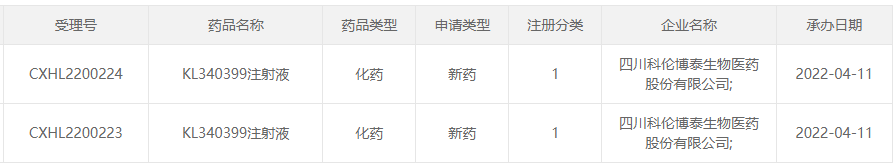
截图来源:CDE官网
KL340399注射液由科伦药业控股子公司四川科伦博泰生物医药股份有限公司开发,具有自主知识产权,是非环二核苷酸(CDN)类新一代小分子STING激动剂。其分子结构稳定、可系统给药,并在体内外药效活性方面有突出表现。非临床研究结果显示,KL340399能与人STING蛋白结合,激活STING信号通路,诱导Ⅰ型干扰素和抗肿瘤细胞因子表达,在多个荷瘤小鼠模型中表现出呈剂量依赖性显著抑制肿瘤生长,且具有与PD-1/PD-L1抗体联用增效的潜质。在安全性评价中,动物耐受性整体良好。
2022年1月,该药获得NMPA临床试验通知书,适应症为晚期实体瘤。
科伦博泰:两款新药获批临床
4月11日,四川科伦药业发布公告,其控股子公司四川科伦博泰生物医药股份有限公司(以下简称“科伦博泰”)开发的创新药物SKB264(TROP2-ADC)联合或不联合KL-A167(PD-L1单抗)一线治疗不可手术切除的局部晚期、复发或转移性三阴性乳腺癌(TNBC)患者的II期临床研究获得国家药品监督管理局(NMPA)临床试验通知书。

截图来源:企业官网
据官方消息,SKB264为科伦博泰拥有自主知识产权的靶向TROP2的人源化单克隆抗体、可酶促裂解的Linker连接着新型拓扑异构酶I抑制剂组合而成的抗体-偶联药物(TROP2-ADC),目前正在中美开展针对多个瘤种,包括三阴性乳腺癌的II期临床试验。
目前SKB264的三项临床试验申请(IND)获得中国国家药品监督管理局(NMPA)批准,包括SKB264单药用于治疗晚期实体瘤和SKB264联用KL-A167分别用于治疗晚期或转移性非小细胞肺癌和三阴性乳腺癌。此外,也获得NMPA同意开展SKB264单药用于至少经二线治疗失败的晚期或转移性TNBC患者的Ⅲ期注册临床试验。
KL-A167为科伦博泰拥有自主知识产权的PD-L1单抗,于2021年11月首次递交KL-A167注射液的鼻咽癌适应症上市许可申请,当前处于审评审批中。科伦博泰将按照国家药品监督管理局签发的临床试验通知书的要求,组织实施注射用SKB264联合或不联合KL-A167一线治疗晚期TNBC的临床试验。
想要解锁更多药企创新药最新进展信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药申报情况、最新进展、研发阶段、临床试验、竞争格局、涉及靶点适应症、销售情况、市场规模与前景,可否投入研发与仿制!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论