
11月8日,CDE承办了百奥泰递交的托珠单抗注射液上市申请。这是我国首家报产的托珠单抗生物类似药。

图片来源:CDE官网
今年4月,百奥泰与Biogen签订协议,约定百奥泰将BAT1806(托珠单抗)注射液在除中国地区以外的全球市场的独占的产品权益(包括开发、生产和商业化)有偿许可给Biogen。百奥泰将保留该产品在中国地区的相关权利。百奥泰可获得总金额最高1.2亿美元的首付款和里程碑款,外加两位数百分比的净销售额分级特许权使用费。
托珠单抗(Tocilizumab)最早由罗氏公司开发,采用哺乳动物细胞(CHO)表达的人源化抗人白介素6受体单克隆抗体制剂。在2020年,其全球销售额达到了28亿瑞士法郎(约合200亿人民币)。
2013年托珠单抗首次在中国获批,用于治疗类风湿性关节炎(RA),商品名为雅美罗。2016年,该药以免3期临床的形式获批新适应症,用于治疗全身型幼年特发性关节炎,它也由此成为中国首个获批用于治疗全身型幼年特发性关节炎的生物制剂。2020年10月,托珠单抗在中国的第三项适应症获得NMPA批准,用于治疗成年和2岁及以上儿童患者由嵌合抗原受体(CAR)T细胞引起的重度或危及生命的细胞因子释放综合征(CRS)。

图片来源:药融云中国批文数据库
然而,托珠单抗在国内的销售却不太乐观,2018-2019年更是连续下滑。2019年8月,托珠单抗被正式纳入中国国家医保目录,作为乙类品种,用于全身型幼年特发性关节炎二线治疗,以及诊断明确的RA经传统DMARD治疗3~6个月疾病活动度下降低于50%的患者。至此,托珠单抗在国内的市场得以快速放量,展现惊人潜力。2020年在全国医院的销售额以132%的增长率突破8000万元,2021年H1更是同比增加525%,市场前景令人期待。
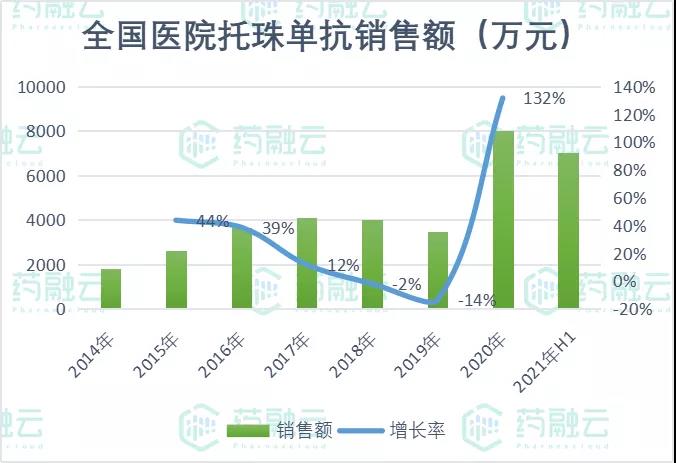
数据来源:药融云全国医院销售数据库
托珠单抗注射液原研产品分子保护的专利已到期,目前,国内有多家企业加入其生物类似药的研发过程中。据药融云数据,包括百奥泰、海正药业、荃信生物、金宇生物、迈博太科药业等。
其中百奥泰进展最快,已递交了上市申请并获受理。荃信生物的QX-003-S、金宇生物的 CMAB806 、海正药业的 HS628 和丽珠单抗的 LZM008 已进行至临床Ⅲ期阶段。

数据来源:药融云全球药物研发数据库;中国临床试验数据库
今年4月,CDE发布了《托珠单抗注射液生物类似药临床试验指导原则》,以更好地推动该产品生物类似药的开发。
—END—


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)













 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论