
石药集团近期在Claudin 18.2靶向药物的研发上可谓频传捷报。继6月16日其Claudin 18.2 ADC新药SYSA1801注射液获批中国临床后,2021年6月28日,石药集团子公司上海新石生物医药有限公司的Claudin 18.2单抗NBL-015注射液临床试验申请获得NMPA受理。

SYSA1801和NBL-015均在美国获批临床,NBL-015还在2020年12月获得了针对治疗胰腺癌的孤儿药资格认定。

中国是胃癌和肺癌高发国家,胰腺癌的病死率也呈上升趋势,对新治疗靶点和新药物具有巨大需求。同时,Claudin 18.2作为极具前景的肿瘤靶向治疗靶点,众多创新药企争相布局,成为必争之靶点高地。
目前为止,国内外超过20家药企布局了claudin 18.2靶向药物的开发,在单克隆抗体、双抗药物、CAR-T均有不错进展。
一、Claudin 18.2极具热度和潜力的靶向治疗靶点
Claudin 18.2(Claudin18亚型2)由CLDN18基因编码,属于Claudin蛋白家族,与occludin 一起,是紧密连接的重要组分。
在正常情况下,该蛋白仅表达在分化的胃粘膜上皮细胞中,在胃干细胞中不表达。当发生癌变时,原发性胃癌及其转移病灶中会表达,同时,在胰腺、食管、卵巢和肺部肿瘤中频繁的出现异位激活,该靶点已成为抗肿瘤药物分子靶点研究热点。
靶向CLDN18.2的抗体可以结合在肿瘤细胞表面,激活细胞内部ADCC(antibody-dependent cytotoxicity,ADCC)和CDC(complement dependent cytotoxicity,CDC)作用,同时可以诱导细胞的增殖和凋亡。
Claudin18 蛋白结构 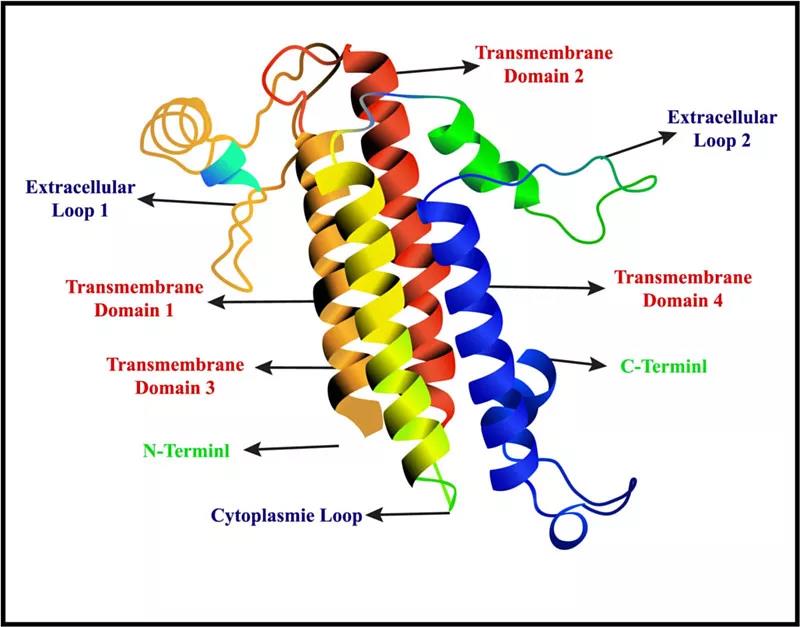

图片来源:参考资料1
不同的Claudin蛋白在正常组织中的表达谱也有差异,Claudin-18具有两个剪接变体,分别为claudin 18.1和claudin 18.2,两者序列之间仅有八个氨基酸的差异。
研究表明,claudin 18.2在正常组织中的表达受到高度限制。Claudin 18.2的异常表达主要发生在胃癌中,同时在胰腺癌、食管癌、卵巢癌等癌种中也有发现。Claudin 18.2参与肿瘤的发生发展,并且位于外细胞膜,可与单克隆抗体、双特性抗体、CAR-T细胞等结合。这些生物学特性都表明claudin 18.2是极具潜力的靶向治疗靶点。
二、全球在研的claudin 18.2药物多方大战在即
全球范围内靶向Claudin18.2靶点的产品类型涉及单克隆抗体、双特异性抗体、CAR-T以及ADC,几乎包含了当下主要的产品形式,以单克隆抗体在研数量最多。
全球在研的claudin 18.2药物
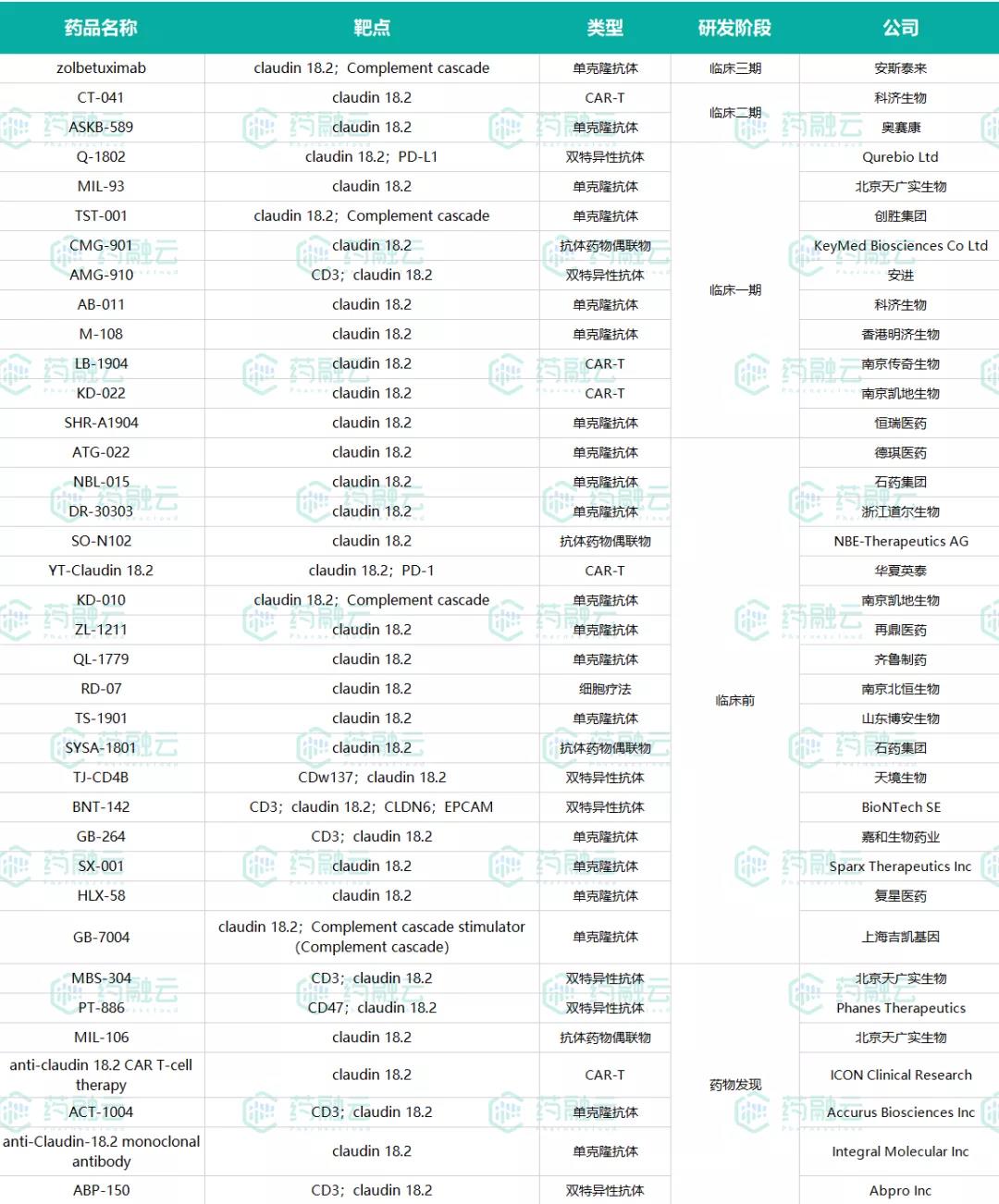
(数据来源:药融云全球药物研发数据库)
根据药融云全球药物研发数据库,全球在研的靶向Claudin18.2药物共有30余款,其中仅有安斯泰来、科济生物、奥赛康的药物进入了临床II/III期试验,其余Claudin 18.2药物均处于临床一期或者更早期研发阶段。
国内布局该靶点的企业众多,还包括创胜集团、北京天广实、恒瑞医药、香港明济生物、南京传奇生物、南京凯地生物、浙江道尔生物、华夏英泰、再鼎医药、齐鲁制药、山东博安生物、南京北恒生物、天境生物、嘉和生物、复星医药、上海吉凯基因等,竞争变得愈发激烈。
接下来,药融云将对已进入临床II/III期试验的3款靶向Claudin18.2药物进行介绍。
三、重点在研药物详解
全球首个针对Claudin 18.2靶点的药物:Zolbetuximab(安斯泰来)
Zolbetuximab(IMAB362,claudixmab)是第一种针对该靶点的开发药物,目前已经推进到临床三期。它是一种嵌合的IgG1单克隆抗体,在肿瘤细胞表面与CLDN18.2特异结合,从而引发抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC),凋亡和抑制细胞增殖。
临床前研究已经成功地证实了它具有清除癌细胞和控制疾病的强大能力。随后,通过多个临床试验评估了其临床疗效和安全性。
Zolbetuximab相关的部分临床试验
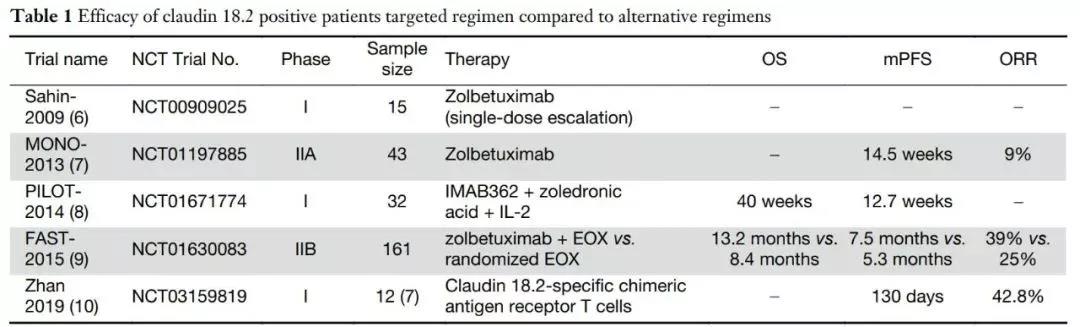
根据发表在《肿瘤学年鉴》上的2期FAST试验的初步结果:
◆ 在整个患者群体中,Zolbetuximab联合EOX组的中位PFS为7.5个月(n=77),而单独EOX组为5.3个月(n=84;心率,0.44;95%可信区间0.29-0.67;P<0.0005)。在Claudin 18.2阳性细胞占70%或以上的患者中,中位PFS分别为9.0个月(n=57)和5.7个月(n=59)(HR为0.38;95%可信区间0.23-0.62;P<0.0005)。在Claudin 18.2阳性肿瘤细胞占40%~69%的患者中,中位PFS分别为4.3个月(n=20)和4.1个月(n=20)(HR为0.71;95%CI,0.32-1.57;P=0.497)。
◆ 在整个患者群体中,Zolbetuximab联合EOX组的中位OS为13.0个月,而单独EOX组为8.3个月(HR,0.55;95%可信区间0.39-0.77;P<0.0005)。Claudin 18.2阳性细胞占70%以上的患者,中位生存期分别为16.5个月和8.9个月(HR,0.50;95%CI,0.33-0.74;P<0.0005)。Claudin 18.2阳性肿瘤细胞占40%~69%,中位生存期分别为8.3个月和7.4个月(HR为0.78;95%可信区间0.40-1.49;P=0.401)。
◆ 每次独立评估的客观有效率(ORR)是Zolbetuximab联合EOX组为39%,而单独用EOX组为25%。根据研究者的评估,ORR分别为37.7%和26.2%。根据独立评估,疾病控制率分别为83.1%和76.2%,根据研究者评估,疾病控制率分别为83.1%和81%。在安全性方面,Zolbetuximab联合EOX组96.1%的患者观察到任何级别的不良反应(AEs),而EOX组为100%。其中,3级及以上不良事件分别占70.1%和64.3%。两组中最常见的不良反应包括恶心、呕吐、中性粒细胞减少和贫血。值得注意的是,接受Zolbetuximab并接受全胃切除术或部分胃切除术的患者(n=8/21)的呕吐发生率低于未接受胃切除术的患者(n=44/56)。
科济生物的Claudin18.2 CAR-T (CT041)
CAR-T 细胞疗法成功的关键是选择正确的靶点作为抗原,即理想的 CAR-T 靶点是应该只在肿瘤细胞表达,这样可以防止 CAR-T 错误地杀伤健康细胞引起不良反应。Claudin 18.2 因其表达模式的特殊性,是 CAR-T 治疗实体瘤具有巨大潜力的靶点。
2019年科济生物公布了 Claudin18.2 CAR-T (CT041) 的单臂开放性临床 I 期结果:
◆该试验入组了 12 例 Claudin 18.2 阳性的晚期胃腺癌或胰腺癌患者,给予其自体 Claudin18.2 CAR-T 细胞治疗,在 11 例可评估的患者中,完全缓解 1 例;部分缓解 3 例,病情稳定 5 例;疾病进展 2 例,总 ORR 为 33.3%,平均 PFS 130 天,未发生严重不良事件、治疗相关死亡或严重神经毒性事件。
目前 CT041在国内有一项开放、多中心、Ib/II期临床试验正在开展(CTR20201940),用于治疗至少二线治疗失败的晚期胃/食管胃结合部腺癌和至少一线治疗失败的晚期胰腺癌。在美国的多中心临床试验也在如火如荼进行,为中国速度点赞。
除去CT041,科济生物管线中还有两款Claudin 18.2药物:AB-011和KJ-C1807。
科济生物研发管线

奥赛康的Claudin 18.2单抗:ASKB-589
2020年4月13日,奥赛康药业宣布ASKB589的临床申请获得NMPA受理。ASKB589为人源化兔抗体,是第三款国产靶向Claudin 18.2抗体药物。
2020年7 月 8 日,奥赛康发布公告,其自主研发、具有自主知识产权的抗肿瘤生物新药「ASKB589 注射液」获批临床,拟用于 CLND18.2 阳性的局部晚期或转移性胃及胃食管结合部腺癌、胰腺癌等恶性实体瘤。目前该药在处于I/II期临床试验,相关临床登记号为CTR20202121、NCT04632108。

参考资料:
1. Prabhsimranjot Singh1, Sudhamshi Toom2 and YiwuHuang3,Anti-claudin 18.2 antibody as new targetedtherapyfor advanced gastric cancer,Journal of Hematology & Oncology (2017)10:105.

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论