根据药融云数据库显示,2021年5月,美国FDA共批准:
·6款创新药,均为全球首次获批上市,包含5个新分子实体,1个双抗。
·6款改良型新药。
·54款仿制药,其中12个仿制药为暂定批准。中国药企获6个ANDA批文,涉及海南普利、东阳光、复星、豪森、健友5个企业。
5月FDA批准的创新药

(数据来源:药融云数据库)
5月FDA批准的改良型新药

(数据来源:药融云数据库)
5月中国药企获批的ANDA批文

(数据来源:药融云数据库)
一、肺癌首个KRAS G12C靶向药——Lumakras
2021年5月28日,美国FDA加速批准安进(Amgen)抗癌药Lumakras(Sotorasib,AMG510)上市,用于治疗携带KRAS G12C突变的非小细胞肺癌(NSCLC)患者。
这是全球首款针对KRAS的靶向药,具有里程碑式的意义。KRAS基因突变长期以来一直被认为是“不可成药”靶点,Lumakras的获批标志着一个全新领域扬帆起航,突破了KRAS“不可成药性”的历史,将为无数携带KRAS突变的癌症患者迎来生存新希望!
Lumakras是特异性靶向KRAS G12C突变体的共价抑制剂,它通过与KRAS G12C突变体结合,将KRAS锁死在失活状态,从而不可逆地抑制KRAS的活性。
临床试验结果
本次FDA的批准是基于II期CodeBreaK 100临床试验的数据,在接受免疫检查点抑制剂和/或铂类化学疗法治疗的124例患有疾病进展的局部晚期或转移性KRAS G12C突变的NSCLC患者中,研究人员评估了Lumakras的疗效。
试验结果显示,接受剂量为960 mg的Lumakras治疗的患者的总缓解率为36%(95% CI:28-45),疾病控制率达到81%(95% CI:73-87),中位缓解持续时间为10个月。
结果还强调,Lumakras是第一个在II期研究中显示无进展生存期(中位数为 6.8 个月)的 KRAS G12C抑制剂,这与先前治疗的KRAS G12C突变晚期NSCLC患者的早期I期结果一致。
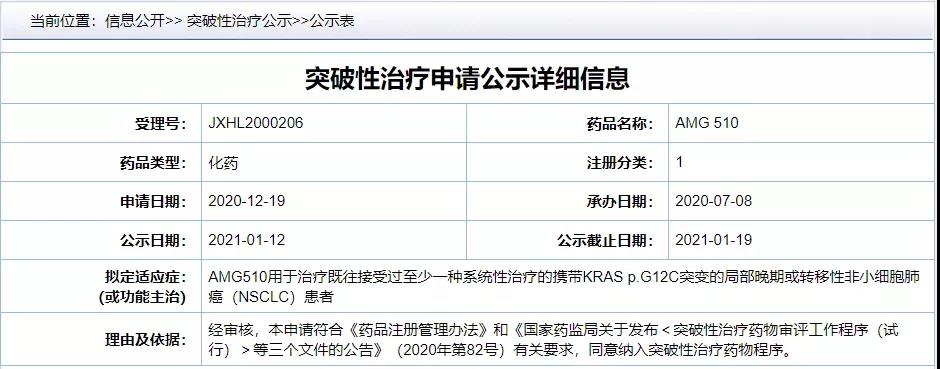
此前,2021年1月21日,Lumakras(AMG510)已被NMPA纳入“拟突破性治疗药物品种”,相信不久的将来,我国此类肺癌患者也将大为获益。
二、胆管癌第二款FGFR抑制剂——Truseltiq
2021年5月28日,FDA宣布批准QED Therapeutics的选择性FGFR1-3激酶抑制剂Truseltiq(Infigratinib,BGJ398)上市,用于治疗曾接受过治疗、携带FGFR2融合或重排的局部晚期或转移性胆管癌(CCA)患者。

Truseltiq是一种口服给药的选择性FGFR酪氨酸激酶抑制剂,这是FDA加速批准的第二款治疗胆管癌(CCA)的FGFR抑制剂,第一个FGFR1-3抑制剂Pemigatinib(Pemazyre,INCB054828)于2020年4月17日被FDA加速批准上市。
临床试验结果
该加速批准基于一项单臂、多中心II期临床试验结果,该研究共纳入 108 名至少接受过一种治疗方案的 FGFR2 融合或重排且不可切除的局部晚期或转移性胆管癌患者。患者接受28天一周期,每日口服一次125mg的infigratinib,直至出现不可接受的毒副反应或疾病进展。
研究结果显示,接受infigratinib治疗的患者,客观缓解率(ORR)达到23%(95%CI:16-32%),中位缓解持续时间(DOR)5.0个月(95%CI:3.7-9.3个月)。另外,患者表现出良好的耐受性,药物安全性良好。
三、创新型精神分裂症药物——Lybalvi
2021年5月28日,美国FDA批准ALKERMES INC新药Lybalvi(olanzapine + samidorphan,ALKS 3831)上市,用于治疗成人精神分裂症和双相1型障碍。
Lybalvi是一种每日口服一次的非典型抗精神病药,由一种新颖的新分子实体samidorphan(新型选择性μ-阿片受体拮抗剂)和一种已上市抗精神病药物奥氮平(olanzapine)制成的一种双层片剂,它能在维持奥氮平疗效的同时减轻奥氮平增加患者体重的代谢异常副作用。Samidorphan是一种阿片受体拮抗剂,通过影响大脑的奖励系统,降低奥氮平带来的体重增加。
临床试验结果
在Lybalvi的 ENLIGHTEN 临床开发项目中(包括2项关键III期研究ENLIGHTEN-1、ENLIGHTEN-2),Lybalvi 证明了抗精神病药的疗效、安全性和耐受性。
ENLIGHTEN-1是一项为期4周的随机、双盲III期研究。结果显示,研究达到了主要终点:与安慰剂组相比,Lybalvi治疗组阳性和阴性症状量表(PANSS)评分相对基线显示出统计学意义的显著降低。
ENLIGHTEN-2是一项为期6个月的随机、双盲III期研究,结果显示精神分裂症患者的体重增加在统计学上显着低于奥氮平。
四、前列腺癌PET新型诊断剂——Pylarify
2021年5月26日,美国FDA批准PROGENICS PHARMS INC正电子发射断层扫描(PET)显像剂Pylarify(piflufolastat F 18)上市,用于识别和定位前列腺癌的疑似转移或复发。
这是第一个也是唯一一个商用的PSMA PET显像剂, 去年12月FDA批准PSMA PET显像剂Gallium 68 PSMA-11(Ga68 PSMA-11)用于医疗机构,但Ga68 PSMA-11只能在几个特定的机构中使用,而PYLARIFY则可以商用。
Pylarify(piflufolastat F18)是一款靶向前列腺特异性膜抗原(PSMA)的放射性氟化小分子显像剂,可以迅速与靶点相结合,从而使PET扫描能够以最快速度完成疾病检测和定位,再加上其本身的氟化小分子可以帮助显像达到高分辨率,使得Pylarify具有良好的诊断性能。
临床试验结果
这项批准是基于两项关键试验的结果:OSPREY和CONDOR。 这两项试验表明,相比于常规显像,PLARIFY PET显像可以改善特异性和阳性预测值,OSPREY试验针对的是在初始治疗前有转移风险的男性,CONDOR试验针对的是生化复发性前列腺癌患者。两项试验中,患者的耐受性都很好。
五、肺癌首款EGFR ex20ins靶向药——Rybrevant
2021年5月21日,美国FDA加速批准强生的EGFR/c-Met双抗Rybrevant(amivantamab),用于治疗患有表皮生长因子受体(EGFR)外显子20插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)患者,使该类患者首次拥有了靶向治疗选择。
Rybrevant是靶向EGFR和cMet的双特异抗体,属于EGFR和MET双靶的单抗静脉输注型药物,与既往的EGFR口服TKI决然不同。
临床试验结果
Rybrevant加速批准是基于Ⅱ期CHRYSALIS研究的结果,对81例接受含铂化疗期间或之后病情进展、携带EGFR外显子20插入突变的NSCLC成人患者评估了Rybrevant的疗效。
结果显示,中位随访9.7个月后,治疗显示出持久的缓解:客观缓解率(ORR)为40%,部分缓解率PR为36%,中位缓解持续时间(DOR)为11.1个月。在病情缓解的患者中,有63%缓解持续时间≥6个月。而20ins使用目前上市的1-3代TKI来说,疗效非常有限,仅10%以下。
六、PNH首款C3靶向药——Empaveli
2021年5月14日,美国FDA加速批准APELLIS PHARMACEUTICALS 的C3补体抑制剂Empaveli(Pegcetacoplan)上市,用于治疗阵发性睡眠性血红蛋白尿症(PNH)成年患者,以及C5补体抑制剂依库珠单抗(Eculizumab)或Ravulizumab治疗无效的PNH患者。这是FDA批准的首款、也是目前唯一一种治疗PNH的C3靶向疗法。

临床试验结果
该药是基于一项三期临床试验(APL2-302;NCT03500549)的临床结果。该项研究纳入80名PNH患者,分别给予Pegcetacoplan和Eculizumab治疗。16周后比较两组患者贫血的严重程度。
结果表明:Pegcetacoplan组血红蛋白水平较基线的变化值(+3.84 g/dL)优效于Eculizumab活性对照组(-1.47 g/dL)(p≤0.0001);Pegcetacoplan组35/41(85%)的患者16周内未输血,Eculizumab组6/39(15%)的患者16周内未输血。
七、中国药企的ANDA批文
5月,海南普利的比伐芦定、东阳光的芬戈莫德、豪森的硼替佐米、健友的替加环素、复星医药旗下GLAND PHARMA LTD的硫酸妥布霉素和重酒石酸肾上腺素获得ANDA批文。
其中海南普利的比伐卢定和豪森的硼替佐米国内已通过一致性评价。

芬戈莫德首仿
值得一提的是,芬戈莫德原研药为诺华的捷灵亚,2010年9月21日获FDA批准上市,是全球首个获批治疗多发性硬化症的口服药物。
2019年12月4日,FDA批准东阳光的盐酸芬戈莫德胶囊首仿上市,同时获批首仿的还有印度药企必奥康和太阳药业,此次为暂定批准。
2020年2月26日,东阳光盐酸芬戈莫德胶囊的上市申请获CDE承办,成为该品种国内首家报产企业。
2020年4月1日,东阳光盐酸芬戈莫德胶囊拟纳入优先审评,纳入理由为“同一生产线生产,已于2019年在美国上市,申请国内上市”。盐酸芬戈莫德胶囊为第一批临床急需境外新药。纳入优先审评后,东阳光药将加速拿下盐酸芬戈莫德胶囊国内首仿。
根据药融云数据,目前该药已进入发补阶段。

数据来源:药融云数据库

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论