
一、引言
2023年12月18日,美国FDA批准了Amryt Pharma提交的桦木三萜凝胶(商品名:Filsuvez®)505(b)(1)新药申请,用于治疗6个月及以上患者因交界型大疱性表皮松解症(JEB)和营养不良型大疱性表皮松解症(DEB)导致的皮肤伤口。该申请获得了FDA孤儿药、罕见儿科疾病和快速通道三项特殊审批认定。在此之前的2022年6月,Filsuvez®获得了欧洲药监局EMA的上市许可。
大疱性表皮松解症(Epidermolysis Bullosa,简称EB)是一组罕见的、涉及各种基因突变的遗传性皮肤病,该病会导致患者皮肤非常脆弱,即使是轻微的摩擦也可能使皮肤破损而在皮肤、黏膜或内脏器官的内部上皮层形成水疱。严重的EB患者可能会经历反复的水疱和皮肤脱落而形成慢性伤口,并可能因慢性贫血、营养不良、反复感染和持续创伤而进一步恶化,且面临侵袭性鳞状细胞癌以及早逝的风险。
桦木三萜(Birch triterpenes)是采用正庚烷为提取溶剂(图1)、从垂枝桦(Betula pendulaRoth)和欧洲桦(Betula pubescensEhrh)或其杂交种的桦树树皮中提取纯化得到一种植物药(Botanical drug substance)。该提取物主要由五种五环三萜类化合物组成,含有72-88%(w/w)桦木醇以及少量的羽扇豆醇、桦木酸、赤藓糖醇和齐墩果酸。提取物桦木三萜是一种白色至近乎白色的粉末,不溶于水,在油中的溶解度也较差。体外研究表明,桦木三萜类化合物能够调节炎症介质,并与细胞内参与角质细胞的分化和迁移的信号通路的激活相关,故能够通过在伤口愈合过程中对炎症和上皮化的影响来加速伤口愈合。
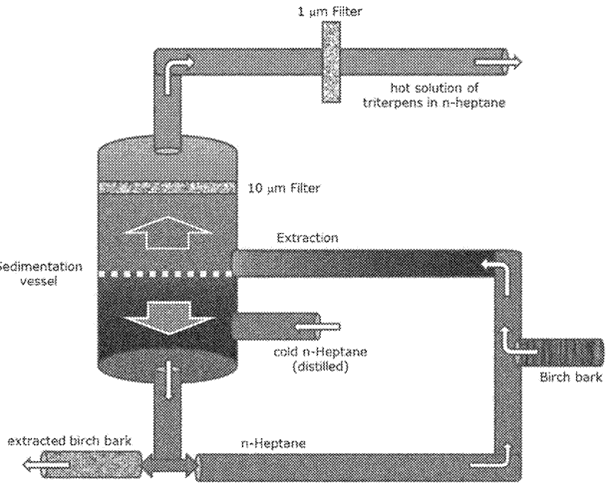
图1 从桦木树皮中提取桦木三萜的装置示意图
Filsuvez®是一种粘稠、无色至微黄色、不透明的、无菌、外用油凝胶。该凝胶处方组成简单,每克凝胶中含有100毫克的桦木三萜和900毫克的精制葵花油。患者需在受影响的伤口表面涂抹一层大约1毫米厚的Filsuvez®凝胶,并使用敷料覆盖伤口,或者将凝胶直接涂抹在敷料上再覆盖伤口,以确保凝胶与伤口的直接接触。
在产品开发过程中,研究者意外发现了一个非常有意思的现象:将桦木三萜提取物与油混合后,桦木三萜提取物颗粒在油中可以通过颗粒表面的羟基和羧基之间形成氢键,这些氢键的相互作用使得这些颗粒能够在油中形成三维网状结构,从而形成可涂抹的、具有触变性的油凝胶(Oleogel)。该发现意味着桦木三萜在作为活性成分的同时,也起到了赋形剂/辅料(Excipient)的作用。这一发现也与近年来对耐受性好、更环保的半固体制剂在制药、化妆品和食品工业中的需求相契合。研发人员对该现象展开了一系列研究,最终推动了Filsuvez®的成功上市。
二、凝胶形成机制研究
从桦木树皮中提取得到的桦木三萜提取物的主要成分是桦木醇(Betulin),含量约占72-88%。这是一种其具有两个极性的羟基基团的五环三萜类化合物,这两个羟基位于分子的两侧(如图2所示)。此外,提取物中的羽扇豆醇、桦木酸、赤藓糖醇和齐墩果酸等化合物也均含有羟基或者羧基基团。
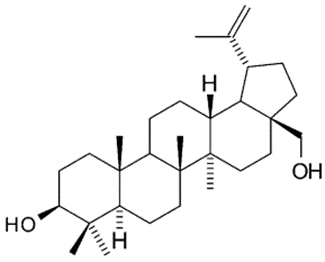
图2 桦木醇的化学结构式
M. Grysko和R. Daniels对桦木三萜在油中形成凝胶的机制进行了深入的研究。研究发现,桦木三萜提取物(以下简称TE)在油中仅微弱溶解,在溶胀后体积仅增加1.8倍,因此不能通过溶胀理论来解释凝胶的成因。而通过荧光和共聚焦拉曼显微镜观察则可以看到悬浮在油中的TE颗粒排列成三维凝胶网络(如图3所示)。

由于桦木醇是TE的主要成分,其化学结构使得在非极性介质中通过氢键发生粒子间的相互作用成为可能。为了验证这种相互作用的存在,研究人员使用了红外光谱法(图4)对TE的混悬液进行了研究。为了更准确地检测氢键的形成,研究人员选择了石蜡作为混悬介质,这是因为石蜡本身不能形成氢键,因此它更适合用来确定凝胶内部是否形成了氢键,而其它的油脂其本身的性质可能会干扰氢键的检测。最终的研究发现,TE在油中通过其表面的羟基和羧基之间形成氢键,这些氢键的相互作用使得这些颗粒能够在油中形成三维网状结构,这是桦木三萜油凝胶形成的关键。
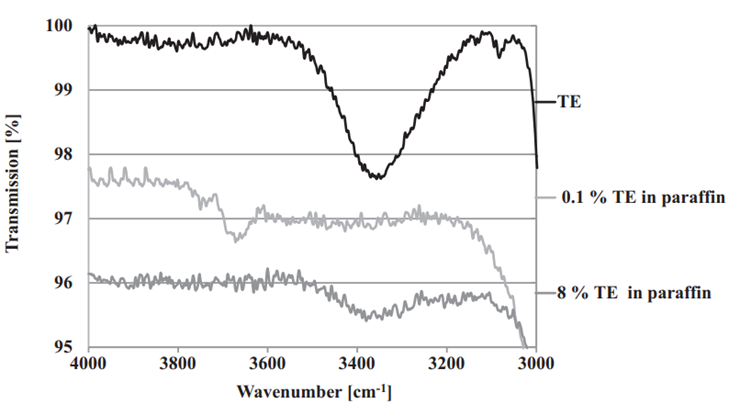
图4 桦木三萜提取物的红外光谱
从图4中可以看出,TE粉末的红外光谱在3500cm⁻¹到3100cm⁻¹之间有一个宽峰,这是TE粉末本身的特征峰。对于低浓度TE混悬液,当TE在石蜡中的浓度为0.1%(w/w)时,在3700cm⁻¹到3600cm⁻¹之间出现了一个峰,这个峰被归自由羟基的振动产生的,表明在低浓度下下,TE中的羟基可能以自由状态存在,尚未形成显著的氢键。而当TE浓度增加到8%(w/w)时,TE粒子开始相互作用并形成油凝胶。此时,在羟基区域的峰发生了显著的位移和展宽(从3500cm⁻¹到3300cm⁻¹),这是因为TE表面羟基和羧基之间形成了氢键,这种氢键的形成使得TE粒子能够稳定地结合在一起,形成油凝胶。
文中还分析指出,TE的浓度对油凝胶具有有显著影响。随着TE浓度的增加,凝胶强度也随之增加,这是因为更高浓度的TE颗粒提供了更多的氢键结合位点,从而增强了凝胶网络的稳定性和强度。通过扫描电镜图像(图5)和比表面积测量发现,TE颗粒的形态和比表面积对凝胶形成也有重要的影响,未经热处理的TE颗粒具有较大的比表面积(42 ± 0.4 m2/g),能够更有效地形成氢键并构建三维凝胶网络,而经过热处理的TE颗粒比表面积减小(21 ± 0.5 m2/g),导致凝胶强度显著降低,这进一步证实了氢键和颗粒形态在油凝胶形成中的关键作用。

图5 桦木三萜提取物扫描电镜图像(A为热处理前;B为120℃热处理2小时后)
对TE颗粒进行热处理(120℃,2h)后,其比表面积显著下降,这种现象与烧结(sintering)过程相似。所谓的烧结是固体颗粒在低于其熔点的温度下,通过表面扩散和重排而相互结合,形成更致密、更坚固的结构。研究人员通过DSC和X射线衍射分析发现热处理后的TE的晶体结构未发生显著变化,但扫描电镜图像清楚地显示了颗粒形貌和比表面积的变化,这表明烧结是一个主要影响颗粒表面和形貌,而非其晶体内部结构的过程。烧结过程中,随着颗粒表面自由能的下降,系统的总自由能也降低,从而使系统进入一个更稳定的状态,这解释了为何在高温下,TE颗粒会发生重新排列以减小比表面积(图6)。热处理使得颗粒变得紧凑,表面羟基和羧基官能团数量减少从而降低了颗粒之间通过氢键形成稳定凝胶网络的能力。
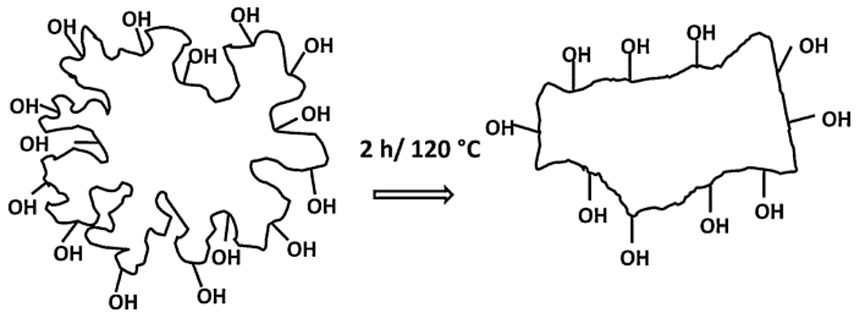
图6 热处理过程中桦木三萜提取物颗粒形貌和比表面积变化示意图
在另一项研究中,研究者考察了不同添加物对桦木三萜油凝胶的凝胶强度的影响(图7),发现一些添加物在桦木三萜油凝胶的制备中可以增强提取物颗粒之间的相互作用,促进颗粒网络的形成,使得在较低浓度的TE下也能形成稳定的油凝胶。该研究也可以表明氢键在桦木三萜油凝胶的形成中起着至关重要的作用。
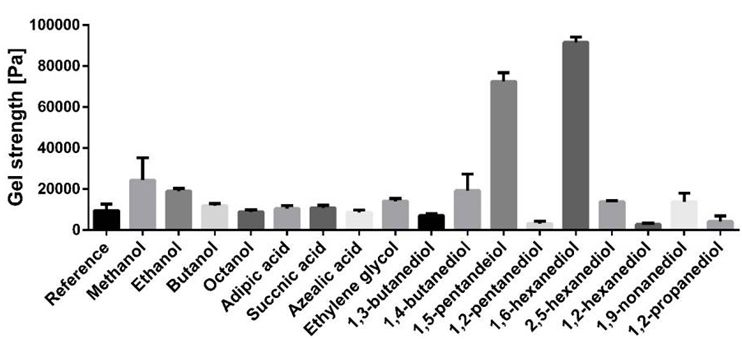
图7 不同添加物对桦木三萜油凝胶的凝胶强度的影响
在一元醇(如甲醇、乙醇、丁醇、辛醇等)中,随着醇分子链长度的增加,凝胶强度逐渐降低。特别是甲醇的添加,对凝胶强度的提升最为显著。使用的二羧酸(如己二酸、琥珀酸、壬二酸)均未对凝胶强度产生影响。这可能是因为二羧酸倾向于形成环状二聚体,这些二聚体更倾向于相互作用,而不是与提取物颗粒结合,因此不影响凝胶网络的形成。所有具有末端羟基的二元醇都能增强凝胶强度,这种增强效果与醇的烷基链长度有关,其中1,6-己二醇的效果最为显著,当添加2%的1,6-己二醇时,凝胶的粘度增加了9倍。然而,随着具有末端羟基的二元醇链长度的进一步增加,凝胶强度又开始下降。这表明存在一个最优的链长范围,使得二元醇能够最有效地增强凝胶网络。含有邻位羟基的二元醇(如1,2-己二醇)则对凝胶强度产生负面影响,这种负面影响同样与链长度有关,其中1,2-己二醇的负面影响最为显著。
三、为什么是葵花油
Steinbrenner等人通过体外伤口愈合模型研究了用9种不同油脂(包括中链甘油三酯、轻质液体石蜡、蓖麻油、花生油、葵花油、杏仁油等)制备的桦木三萜油凝胶对伤口愈合的影响(图8)。
在所有的空白油脂中(不加桦木三萜提取物),中链甘油三酯(Miglyol)促进伤口愈合的效果最为显著,显示出约1.4倍的改善效果。而蓖麻油(约0.3倍)、轻质液体石蜡(约0.5倍)、杏仁油(0.6倍)则显著抑制了伤口愈合。此外,辛基十二醇、花生油、荷荷巴油、肉豆蔻酸异丙酯酯和葵花油也显示出相对于未处理对照组的伤口愈合抑制趋势。
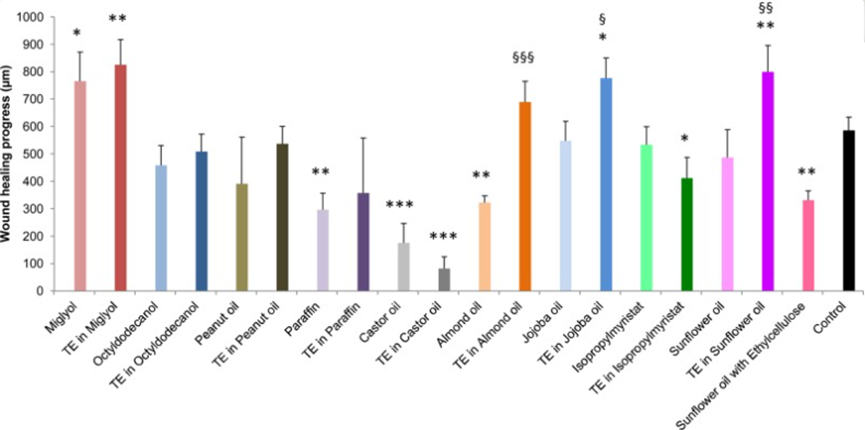
然而,将桦木三萜提取物(简称TE)添加到不同类型的油脂中制备成油凝胶后,与未TE的空白油脂相比,添加了TE的葵花油油凝胶在促进伤口愈合方面表现出显著的优势,效果是空白葵花籽油的1.64倍。相较于未处理的对照组,添加了TE的葵花油油凝胶显著提高了伤口愈合效果(1.45±0.17倍)。尽管中链甘油三酯(Miglyol)油凝胶相较于未处理的对照组有显著效果,但与空白中链甘油三酯(Miglyol)相比,其并未表现出额外的伤口愈合促进作用。
体外释放实验表明,中链甘油三酯(Miglyol)油凝胶中释放的主要成分桦木醇(betulin)的速率显著低于从葵花油油凝胶中释放的速率。另外,研究者使用中链甘油三酯(Miglyol)、葵花籽油作为油相制备的水包油乳液,结果表明从乳液中释放的桦木醇量明显低于相应的油凝胶。因此,选择葵花油作为油脂制备桦木三萜油凝胶是一条合理的制剂开发路线。
参考文献:
[1] Grysko, M.,Daniels, R.(2013). Evaluation of the mechanism of gelation of an oleogel based on a triterpene extract from the outer bark of birch. Pharmazie, 68(7), 572-577.
[2] Steinbrenner I, Houdek P, Pollok S, Brandner JM, Daniels R. Influence of the Oil Phase and Topical Formulation on the Wound Healing Ability of a Birch Bark Dry Extract. PLoS One. 2016 May 24;11(5):e0155582.
[3] Schwieger-Briel A, Ott H, Kiritsi D, Laszczyk-Lauer M, Bodemer C. Mechanism of Oleogel-S10: A triterpene preparation for the treatment of epidermolysis bullosa. Dermatol Ther. 2019 Jul;32(4):e12983.
[4] Jäger S, Laszczyk MN, Scheffler A. A preliminary pharmacokinetic study of betulin, the main pentacyclic triterpene from extract of outer bark of birch (Betulae alba cortex). Molecules. 2008 Dec 18;13(12):3224-35.
[5] Ghaffar KA, Daniels R. Oleogels with Birch Bark Dry Extract: Extract Saving Formulations through Gelation Enhancing Additives. Pharmaceutics. 2020 Feb 21;12(2):184.
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论