
诺如病毒(NoV)原名诺瓦克病毒,是一种肠道无包膜病毒,具备环境抵抗力强、病毒变异快等特点,且在在全人群普遍易感,会引起呕吐和腹泻,是造成全球急性胃肠炎(AGE)的主要原因。虽然诺如病毒早在50多年前就被发现,但是由于其变异快、难以在体外培养、临床试验难度大等特点,且又属于自限性疾病,目前全球尚未有针对诺如病毒的疫苗上市。不少药企其实早就在进行诺如病毒等相关疫苗的研发,比如日本的武田制药和专注开发口服疫苗的Vaxart公司,而武田从2012年启动全球疫苗业务以来,就已将诺如病毒疫苗的需求确定为公司的关键优先事项。为了更专注于该领域,2021年7月,武田制药和医药投资机构Frazier Healthcare Partners(以下简称Frazier)宣布合作成立生物制药公司HilleVax,以开发和商业化武田制药的诺如病毒候选疫苗。这也是武田和Frazier于2019年成立Phathom Pharmaceuticals(主要致力于胃肠疾病的创新疗法)之后的再次合作。
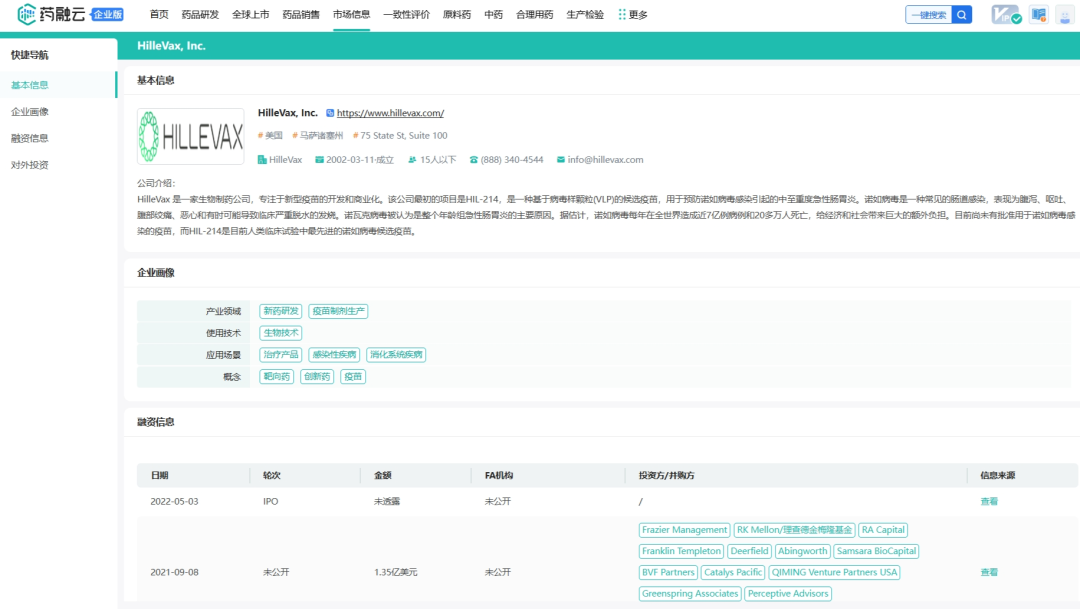
截图来源:药融云数据库
从药融云数据库获悉,HilleVax的管理层由董事长兼首席执行官Rob Hershberg博士领导,他是Frazier的合伙人,此前曾创办VentiRx、Corixa等多家被收购的医药公司。在宣布成立之后的两个月,Hillevax就获得了由Frazier领投的1.35亿美元交叉轮融资;次年5月,凭借处于临床试验后期的管线,HilleVax通过IPO在美国纳斯达克上市,发行总收益约为2.3亿美元,高于公司最初的预计收益,可以说与当时的IPO干旱格格不入;除此之外,在2023年9月,HilleVax宣布完成普通股的承销公开发行,在扣除承销折扣和佣金以及其他发行费用之前,从此次发行中获得的总收益为1.15亿美元。截止2024年6月14日,HilleVax公司市值7.50亿美元。发稿前,市值为8100万美元。重大大跌原因是:2024年7月8日,Hillevax的二价诺如病毒疫苗婴儿2b期临床NEST-IN1试验顶线数据,针对预防急性肠胃炎的主要终点未达到。
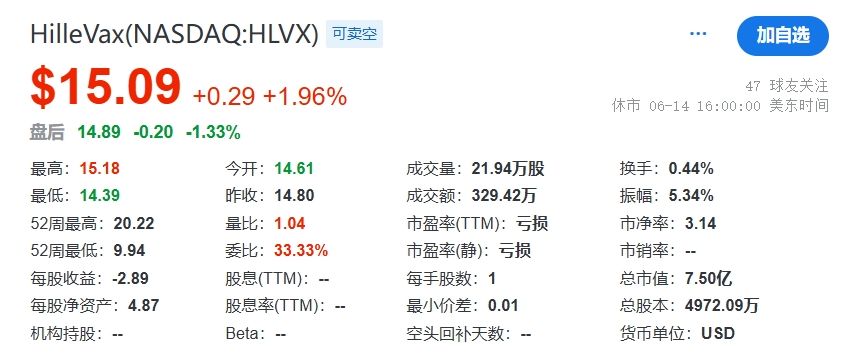
新增管线,引自中国
2024年1月,HilleVax和成都康华生物宣布达成独家许可协议,康华生物授权HilleVax在除中国(含港澳台)以外地区对重组六价诺如病毒疫苗(产品代号HIL-216)及其衍生物进行开发、生产与商业化。此次交易康华生物获得1500万美元的首付款,并在实现特定的开发和销售里程碑时有望获得2.555亿美元的里程碑款项,康华生物还有权在除中国(含港澳台)以外地区的净销售额上获得个位数百分比的销售提成。

HIL-216是康华生物采用基因工程技术构建的基于病毒样颗粒(VLPs)的重组六价诺如病毒疫苗,包括六种诺如病毒主要流行基因型——GI.1、GII.2、GII.3、GII.4、GII.6和GII.17,理论上可以预防90%以上的诺如病毒感染及其引起的急性肠胃炎。HIL-216已于2023年2月取得澳大利亚临床试验许可,并于2023年9月取得美国临床试验许可,在中国大陆地区暂未取得临床试验许可,是全球首款且唯一获得临床许可的六价诺如病毒疫苗。康华生物将提供HIL-216予HilleVax于近期临床试验中使用,公司计划在2024年启动临床试验1期研究。
先进管线,武田授权
除了从康华生物引进的项目外,HilleVax在研管线中还有二价诺如病毒疫苗——HIL-214,这是武田原代号为TAK-214的项目,目前已研发了数十年。成立HilleVax之初,武田向HilleVax授予该项目在日本以外的全球独家开发和商业化权利许可,其保留了在日本的商业化权利。
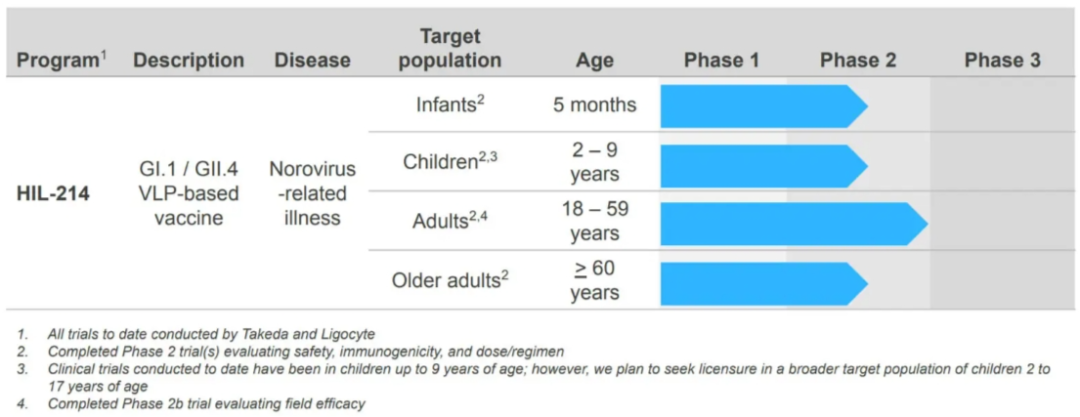
HIL-214是一款基于VLP的二价诺如病毒疫苗,包含了GI.1和GII.4两种病毒型别(导致人类胃肠炎的最主要基因型),目前正在开发用于预防由诺如病毒感染引起的中毒至重度急性胃肠炎(AGE)。诺如病毒有七个已知的基因群,但只有基因群I和II是绝大多数人类病例的罪魁祸首,极少数病例归因于诺如病毒GIV。虽然基因群I和基因群II都具有临床相关性,但来自基因群II的特定菌株诺如病毒GII.4是造成大多数人类疫情的原因。此外,与其他菌株相比,GII.4菌株产生的疾病往往更严重,死亡率更高。
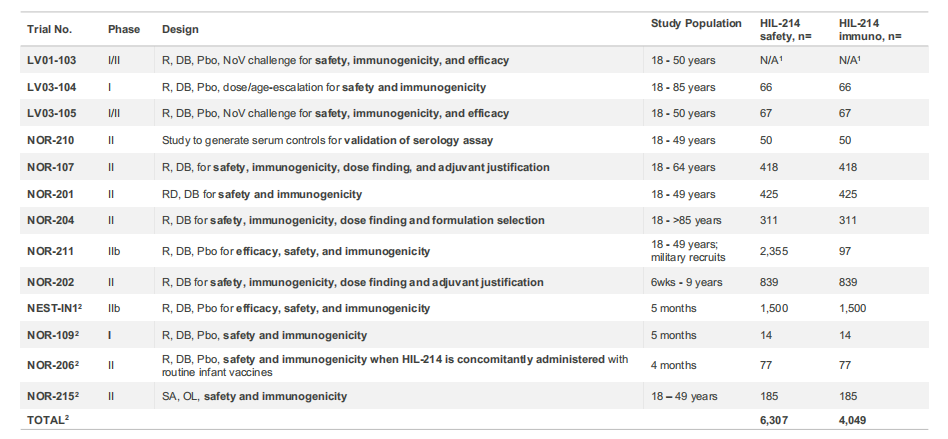
图表:证明HIL-214免疫原性、有效性、安全性和耐受性的临床试验
2022年5月,HilleVax宣布启动了一项临床试验2b期研究(NEST-IN1试验),该试验是一项随机、双盲、安慰剂对照研究,旨在评估HIL-214在约5个月大的婴儿中的安全性、免疫原性和有效性。2022年12月,HilleVax报告了NEST-IN1试验前203名受试者的中期免疫原性数据,免疫原性结果显示:(1)HIL-214第二次给药后28天,pan-Ig(泛免疫球蛋白)抗体几何平均滴度(GMT)的GI.1和GII.4分别为11,102.0 IU/mL和2,185.5 IU/mL,而安慰剂组的GI.1和GII.4分别为59.6 IU/mL和73.5 IU/mL。这些滴度对应于hIL-214相对于基线的几何平均倍数上升(GMFR)超过18倍。(2)HIL-214的血清应答率(SRRs)在NOR-212中定义为与接种前基线相比,第二剂接种后28天的pan-Ig抗体滴度至少增加4倍的受试者的百分比,GI.1为99.0%,GII.4为86.9%。安慰剂组GI.1和GII.4的SRR分别为4.1%和3.1%。与公司先前对婴儿HIL-214研究的预期一致。2023年4月份,HilleVax宣布完成NEST-IN1试验3000多名受试者的招募,以评估HIL-214在婴儿中的安全性和有效性,预计将在2024 年年中报告NEST-IN1 的顶线数据。

HilleVax在优先考虑对婴儿群体进行登记注册的同时,还计划在其他年龄组中寻求HIL-214的批准。2023年第三季度,HilleVax启动了三项支持HIL-214进展的临床试验,包括:(1)NOR-109试验:HIL-214在日本婴儿中的临床试验1期研究;(2)NOR-206试验:将HIL-214与其他标准婴儿疫苗接种联合使用的临床试验2期研究;(3)NOR-215试验:针对成人的HIL-214临床试验2期血清学研究。截至目前,公司已完成三项临床试验的受试者入组。
财务状况
2023年度HilleVax的研发费用为1.067亿美元,上年同期4590万美元,这一增长主要是由于HIL-214开发活动的增加和研发人员数量的增加;一般和行政费用为2670万美元,上年同期为1670万美元,这一增长也是由于一般和行政员工人数的增加;净亏损为1.236亿美元,上年同期为1.598亿美元。HilleVax2023年度其他收入为980万美元,该项收入主要由现金、现金等价物和有价证券的利息收入推动。
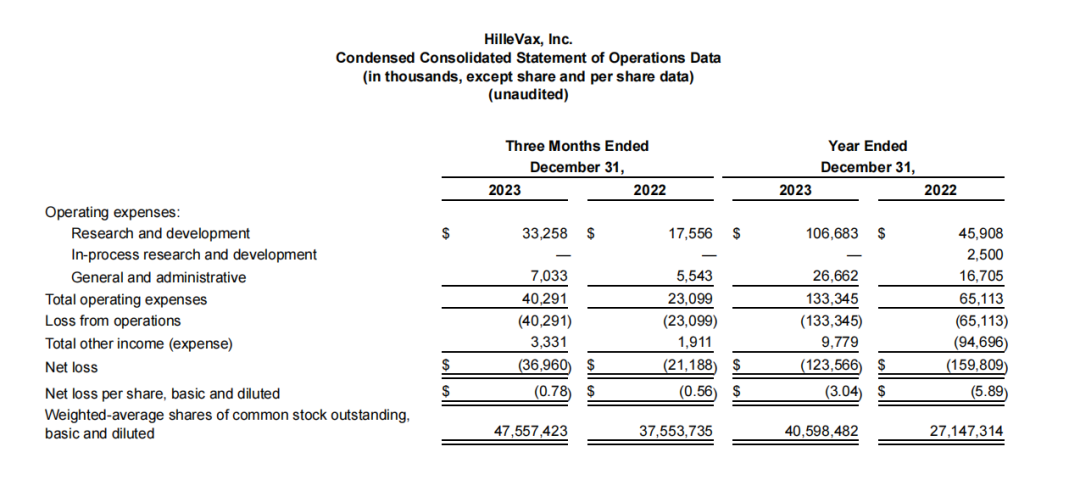
2024年第一季度的研发费用为2600万美元,这一增长主要是由于研发人员数量的增加;一般和行政费用为850万美元,而上年同期为580万美元,这一增长还是由于一般和行政员工人数的增加;2024年第一季度的净亏损为4680万美元,而2023年第一季度为2690万美元。其他收入为300万美元,而2023年第一季度为210万美元。与2023年第一季度相比,2024年第一季度的增长也是由有价证券的增加推动的。
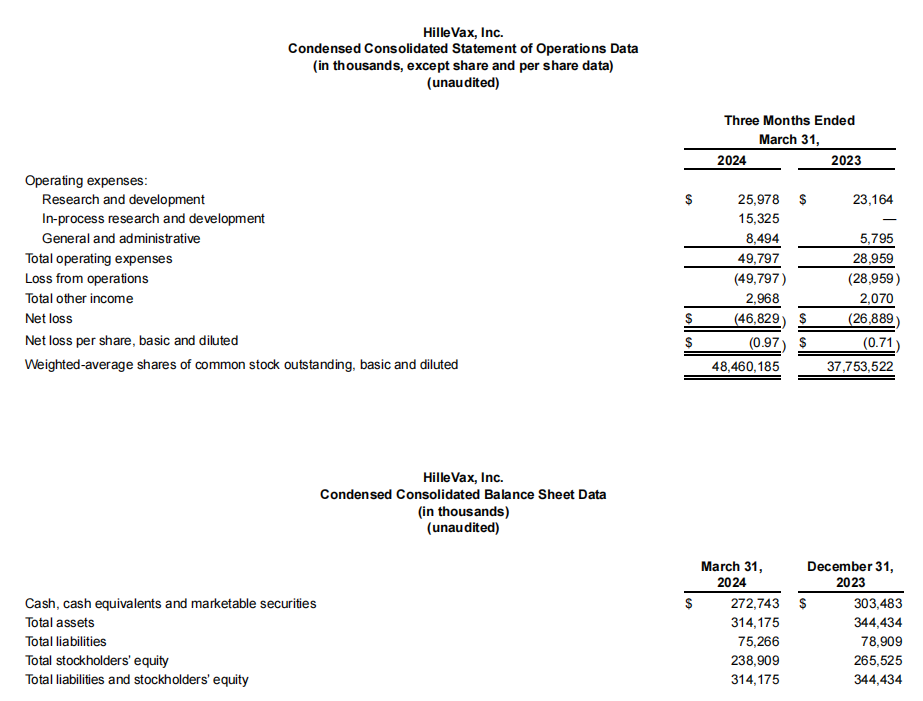
截至2024年3月31日,HilleVax拥有现金、现金等价物和有价证券总额为2.727亿美元。
结语
从药融云数据库获悉,目前国内外有不少企业在进行诺如病毒疫苗的研究,在国内,除康华生物外,还有数家公司布局此疫苗,其中远大赛威信公司研发的四价重组诺如病毒疫苗已取得临床试验许可,智飞生物的四价重组诺如病毒疫苗正在进行临床试验2期研究......HilleVax与康华生物的合作,是中国疫苗出海的领航,也是中国药企努力把创新标签展示给全球的证明,日后中国药企一定能够为全球患者提供更放心且有效的产品。
药融云数据库:全球药物研发
参考来源:
[1] 药融云数据
[2] FDA/EMA/PMDA
[3] 相关公司公开披露(除标注外,正文图片均来自企业官网)
https://ir.hillevax.com/
https://www.nature.com/articles/s41541-024-00884-2
https://www.biopharmape.com/news/hillevax-belite-bio-ipos-biotech-downturn/622785/
https://www.ncbi.nlm.nih.gov/books/NBK513265;等。
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论