癌症,即恶性肿瘤,是人类健康领域中的一大难题,已成为导致人类死亡的主要原因之一,也是生命科学领域的重要研究方向之一。
目前肿瘤的常规治疗包括化疗和靶向治疗,尽管化疗在临床上应用十分广泛,但由于其对于肿瘤细胞,和正常细胞均可发挥细胞毒作用,故而存在较多不良反应。靶向治疗通过抑制肿瘤相关特定分子靶点,但由于癌细胞基因突变位点的可能变化,使得靶向治疗不可避免地存在耐药性。
近年来,细胞疗法被认为是癌症治疗领域的一大突破。其中,CAR-T疗法方兴未艾,已成为多种血液肿瘤的替代治疗方法,CAR-T细胞免疫疗法给血液系统恶性肿瘤患者带来了新的希望,让难治性、复发性血液系统恶性肿瘤有了治愈的可能。
2023年5月,世界上首例接受CAR-T治疗的著名抗癌明星艾米莉迎来无癌生存的第11周年。以往的抗癌药物,以延长寿命、提高生活质量为目标,CAR-T则着眼于“治愈”这一目标。
CAR-T疗法全球新闻资讯查询
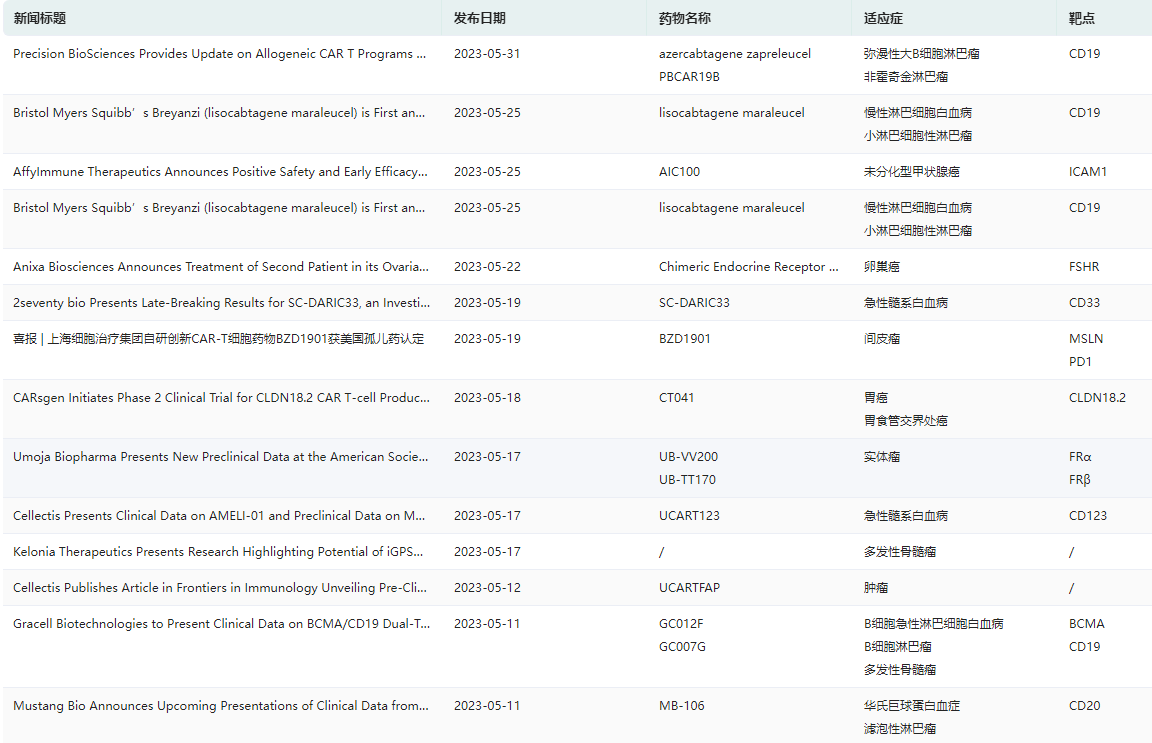
图片来源:药融云新闻资讯数据库
一、CAR-T细胞免疫疗法的作用机制
CAR-T细胞技术(ChimericantigenreceptorTcell)是基于T细胞一种细胞免疫技术,T细胞通过基因编辑加入嵌合抗原受体,从而形成CAR-T细胞,该嵌合抗原受体使T细胞靶向特定疾病细胞(例如肿瘤),并且可以诱导旨在杀伤靶细胞的细胞毒性反应。
CAR-T杀伤肿瘤的机制为:CAR识别肿瘤抗原后,激活T细胞的免疫通路,相关基因表达上调,分泌颗粒酶、穿孔素等物质直接介导肿瘤细胞溶解,同时也分泌粒细胞巨噬细胞集落刺激因子(GM-CSF)、干扰素-γ(IFNγ)等炎症因子,招募巨噬细胞等固有免疫细胞杀伤肿瘤组织。
二、CAR-T细胞疗法的全球研发进展
细胞治疗中CAR-T发展最成熟,根据弗若斯特沙利文数据,全球CAR-T细胞治疗市场规模从2017年的4.6亿美元增长到了2019年的27亿美元,未来将持续增长,2024年全球CAR-T细胞治疗市场规模将达到116亿美元。
从2012年至今,CAR-T多次上演“神迹”,全球超过25个研究中心证实了其治疗白血病、淋巴瘤等疾病时的有效性。因其治疗癌症的势头猛烈,2017年8月,美国批准了诺华公司的突破性CAR-T新药Kymriah,这是全球首个获批的CAR-T疗法。
经药融云数据库查询显示,截至目前全球已有8款CAR-T疗法批准上市,包括:Yescarta(axicabtagene ciloleucel,阿基仑赛)、Tecartus(brexucabtagene autoleucel)、Breyanzi(lisocabtagene maraleucel)、Kymriah(tisagenlecleucel)、瑞基奥仑赛、Abecma(idecabtagene vicleucel)、西达基奥仑赛(ciltacabtagene autoleucel,Carvykti)、ARI-0001。
全球上市的CAR-T细胞疗法查询(登录“药融云数据库www.pharnexcloud.com/?mh”可查看更多内容)
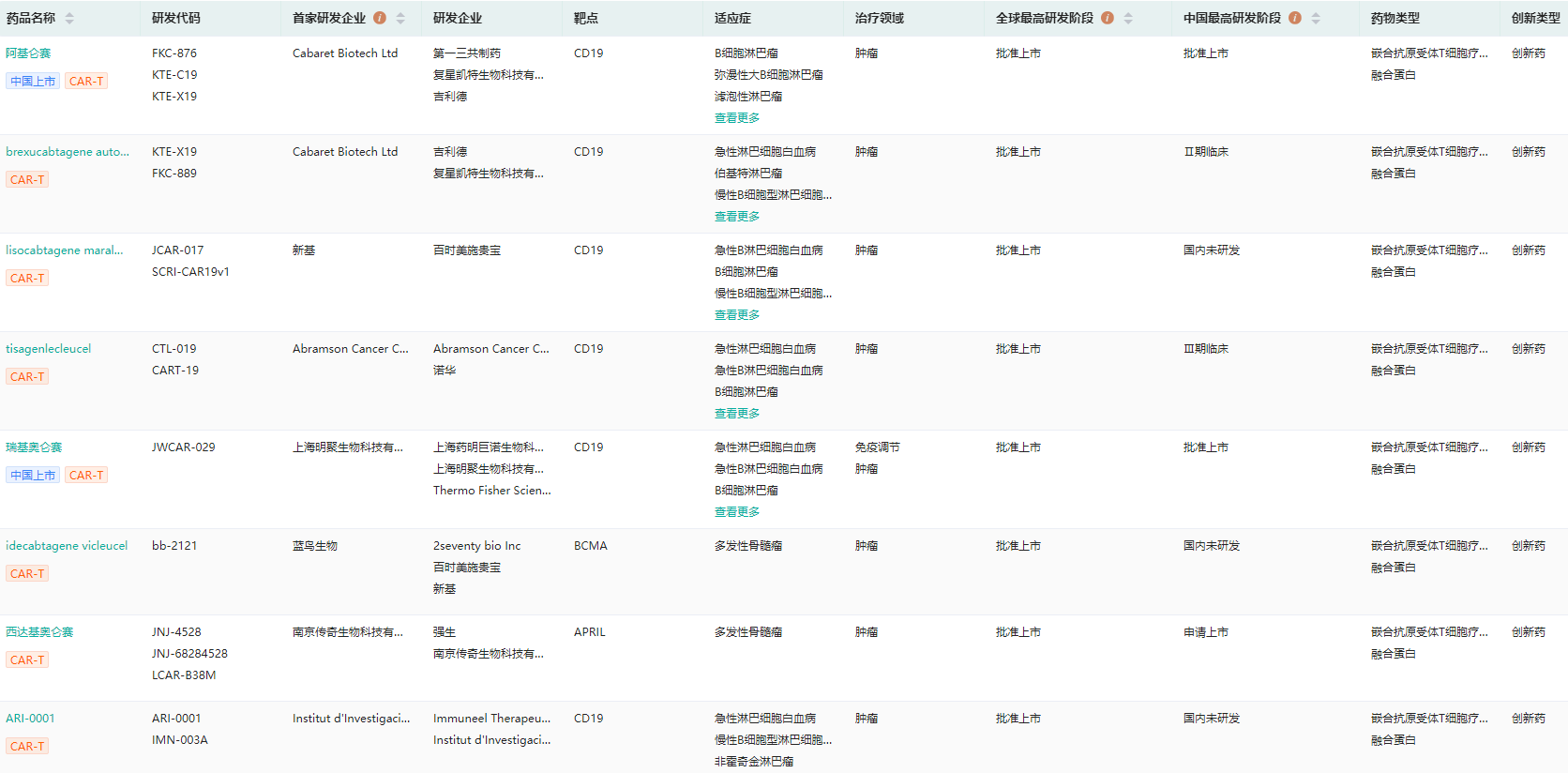
图片来源:药融云全球药物研发数据库
目前已上市的8款CAR-T产品中有6款疗法靶向CD19抗原,2款靶向BCMA抗原,且均针对血液肿瘤。其中有两款CAR-T产品在国内获批,分别是吉利德科学公司/复星凯特的阿基仑赛注射液(商品名:奕凯达),是中国首个获批的CAR-T药物;与药明巨诺的瑞基奥仑赛注射液(商品名:倍诺达)。同时,在国内已提交上市申请的还有四款,分别是赫基仑赛、西达基奥仑赛、equecabtagene autoleucel、泽沃基奥仑赛。
值得一提的是,传奇生物首款自主研发的BCMA CAR-T产品Carvykti获得FDA批准在美国上市,用于治疗复发或难治性多发性骨髓瘤(R/R MM)患者,成为中国首款原创并成功出海的CAR-T产品,让国产免疫细胞治疗技术迈上了国际舞台。
西达基奥仑赛全球研发详情查询
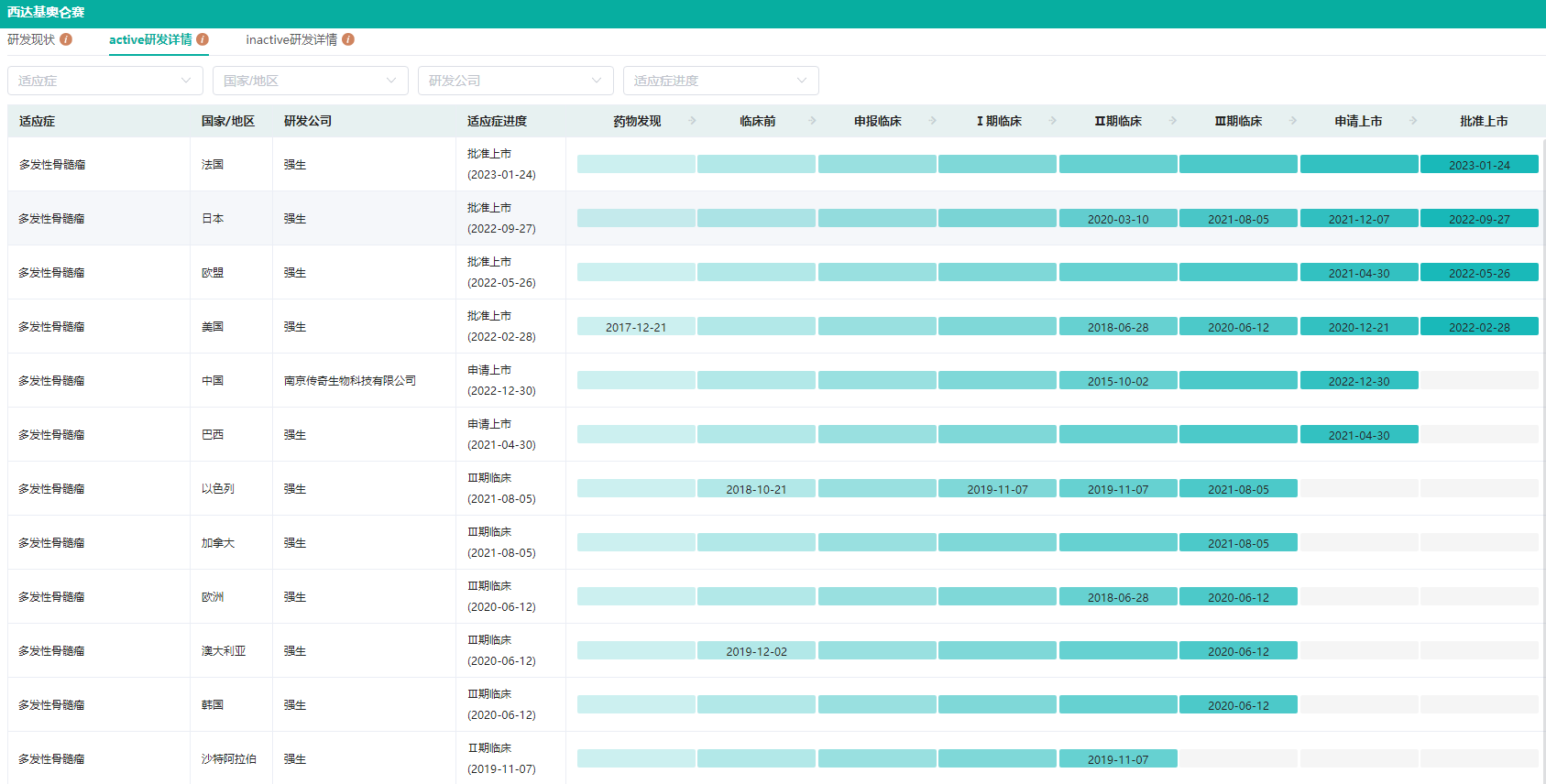
图片来源:药融云全球药物研发数据库
药融云全球药物研发数据库显示,目前全球在研CAR-T药物数量有1100余种,涉及200多个靶点;根据靶点的研究数量,TOP10靶点依次是:CD19、BCMA、CD22、CD20、MSLN、HER2、EGFR、GPC3、CD33、CD276。
从适应症来看,排名前十的分别为:造血或淋巴组织肿瘤、恶性肿瘤、血液或造血器官疾病、非霍奇金淋巴瘤、实体瘤、B细胞淋巴瘤、多发性骨髓瘤、淋巴样白血病(恶性)、急性B淋巴细胞白血病、急性骨髓性白血病。
三、CAR-T细胞免疫疗法的优缺点
CAR-T细胞治疗作为一项新兴疗法,其优点显而易见。首先,具有高度特异性和强大的杀伤力,可以杀死特定抗原所表达的癌细胞而对正常细胞保持极小的影响;其次,能够确立长期的免疫记忆,对特定癌细胞具有长期、不间断的杀伤作用;第三,CAR-T细胞针对癌细胞某一种特定抗原的改造不易受到癌症演变和变异等因素的影响。
然而,CAR-T细胞治疗疗程中也存在一些痛点,比如可能会引起例如CRS(细胞因子综合释放综合征)和ICANS(免疫效应细胞相关神经毒性综合征)等不良反应;肿瘤相关抗原逃逸导致癌症复发(如CD19逃逸);在慢性白细胞白血病和非霍奇金淋巴瘤中需要提高效应活力;在实体瘤中表现未达预期;通用型CAR-T还未真正走向临床,前几代的CAR-T治疗制备过程繁琐,难度大,成本过于高昂等。
因此,CAR-M、基于iPSC的CAR-T疗法等新型细胞疗法应运而生。
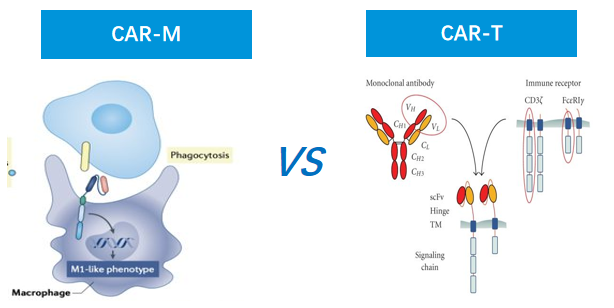
四、新型细胞疗法——CAR-M疗法
CAR-M细胞疗法是指将经过编辑的特定CAR基因植入巨噬细胞,以装备巨噬细胞,使之能够通过特异性抗原与肿瘤细胞表面结合并随后激活巨噬细胞的活性,进而实现肿瘤杀伤功能。
CAR-M疗法疗法操作流程为:先从患者血液中分离出原代单核细胞,然后用所需的抗原特异性嵌合受体转导细胞,重新融合的CAR-M细胞被募集到患者肿瘤部位。如同CAR-T技术一样,CAR-M细胞能靶向并识别癌症细胞并将其吞噬降解。而在吞噬降解后,巨噬细胞能过起到抗原呈递的作用,反过来将激活T-细胞。
2016年,首家CAR-M公司Carisma成立,宾夕法尼亚大学的CAR-T细胞治疗专家Saar Gill和Michael Klichinsky创立了Carisma Therapeutics公司,致力于开发CAR-M疗法用以治疗肿瘤。经过几年的发展,2021年Carisma团队宣布已完成CT-0508的1期临床研究首例患者给药,这是首个进入临床的CAR-M疗法,开启划时代新纪元。
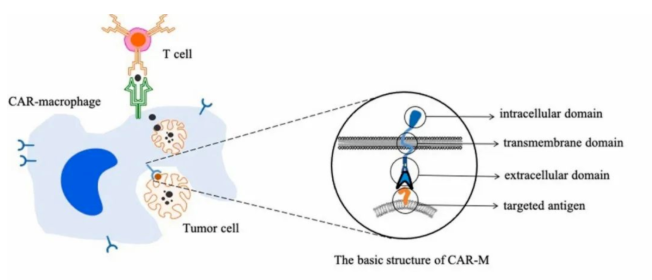
CAR-M疗法成为实体瘤免疫治疗的新候选者,但是也面临着一些挑战:由于巨噬细胞不会增殖,患者只能接受有限数量的巨噬细胞,这可能会影响治疗效果;外源性巨噬细在体内大部分会留在肝脏,不利于癌症的治疗;在小鼠模型中取得了很好的效果,但人类实际的肿瘤微环境要比动物模型复杂得多;在CAR-T治疗中发现,大多数被CAR-T细胞去除的肿瘤细胞都有高水平的靶抗原表达,可以预见,这也将成为CAR-M疗法发展的一大障碍。
Carisma Therapeutics在2023年的ASGCT摘要中公布了CT-0508治疗HER2+实体瘤患者的I期临床试验数据。结果显示在安全性、耐受性、细胞制造可行性、运输、TME激活以及研究药物方面,CT-0508对18例局部晚期(不可切除)/转移性HER2过度表达实体瘤患者已取得了初步成果。CAR-M是否能够赶超CAR-T疗法,成为下一个细胞疗法风口?让我们拭目以待。
CT-0508临床试验详情查询
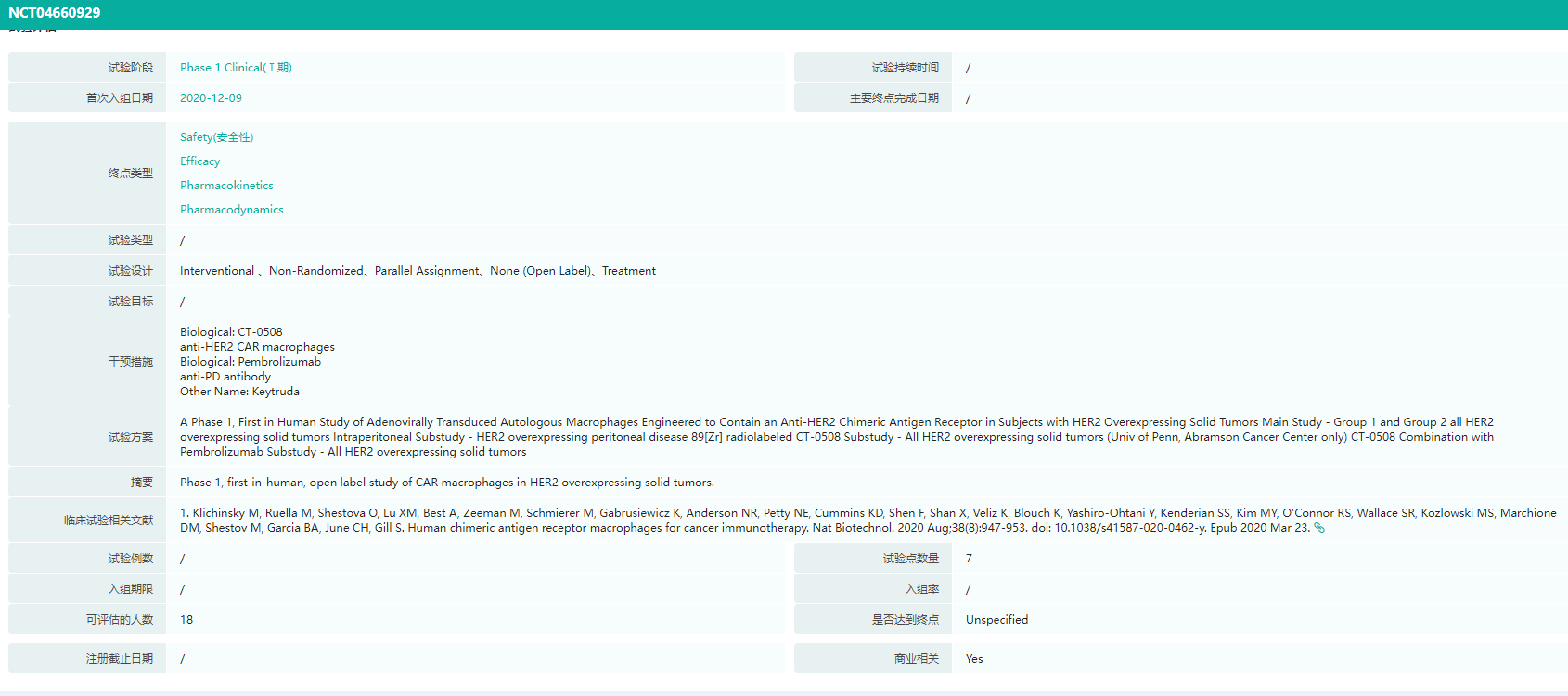
图片来源:药融云全球临床试验数据库
五、CAR-T-iPSC:iPSC和基因编辑技术助力“现货”型T细胞疗法
诱导性多功能干细胞(induced pluripotent stem cells,IPSCs),也就是IPS细胞,是山中申弥(Shinya Yamanaka)通过研究对人体组织的细胞进行重新编程而得到的类似胚胎干细胞的一种细胞类型。它们可以通过自我更新以及分化直接再生器官或者组织,也可以通过重建微环境促进受损组织恢复。
传统CAR-T细胞疗法需要提取患者自已的T细胞,在体外经过工程化改造然后回输到患者体内,极具个性化。一种疗法针对一个患者,每个患者的细胞和接受过的治疗都不同,制备相对复杂,生产周期比较长,费用也比较高。
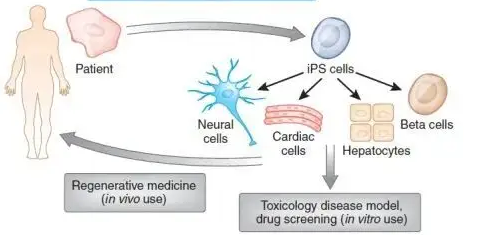
IPSC细胞系经过基因工程的改造,分化生成的T细胞不会导致患者的免疫排斥反应。在需要时,它们可以被扩增,成为“通用型”T细胞疗法。iPSC技术与CAR-T结合,可以有效解决T细胞耗竭的问题并有效地增强免疫力。
药融云数据库显示,2020年7月,Fate Therapeutics公司的FT-819成为首个获得美国FDA IND批准的iPSC来源的同种异体CAR-T细胞疗法,用于治疗复发/难治性B细胞恶性肿瘤;并于2021年8月完成首例患者给药。FT-819临床前表现良好,具有多项首创功能,旨在解决CAR-T相关局限性。
FT-819全球研发详情查询
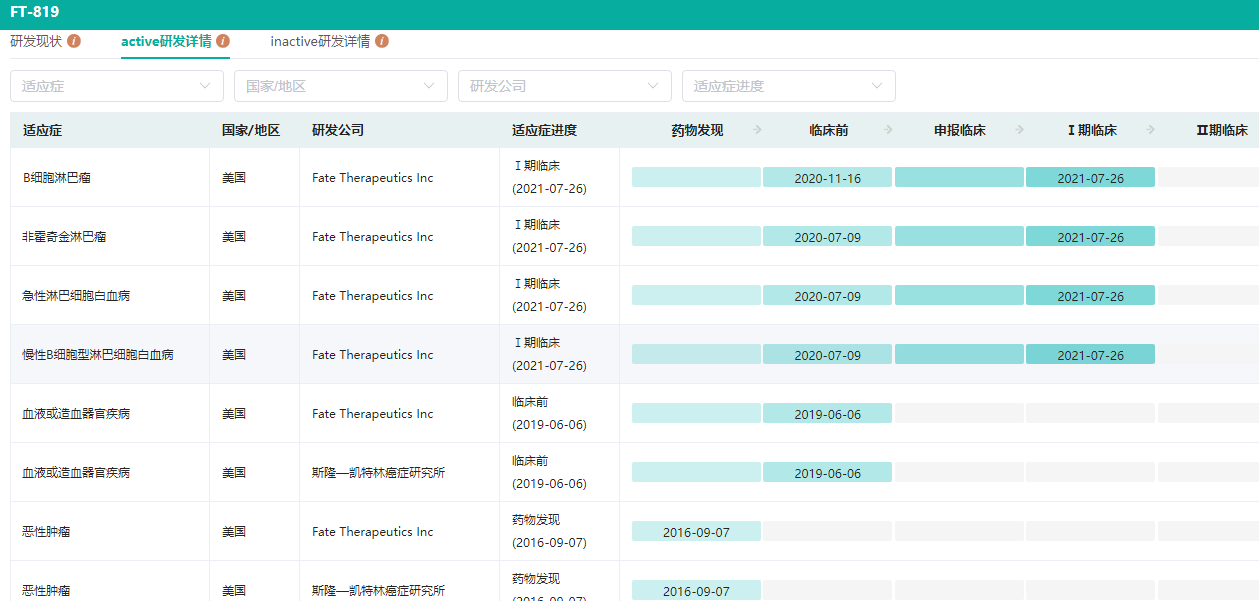
图片来源:药融云全球药物研发数据库
目前,国际上开发基于iPSC技术的细胞治疗代表公司还有Cynata Therapeutics、BlueRock Therapeutics、Sana Biotechnology、Vertex Pharmaceuticals、Heartseed、Century therapeutics、武田制药等。在国内的代表公司有上海星奕昂、百济神州、齐鲁制药、艾凯生物、赛元生物、北京呈诺医学、中盛溯源、浙江霍德生物、艾尔普再生医学、苏州易慕峰生物、士泽生物等。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论