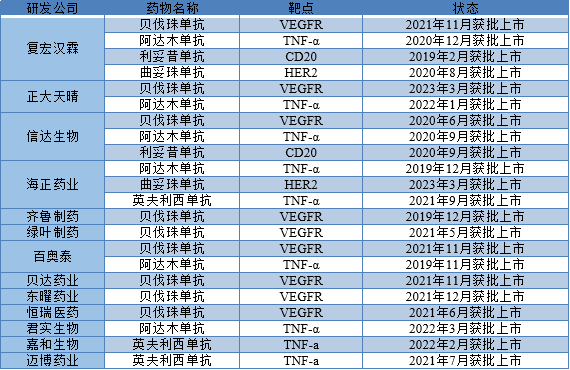
生物制药特点之一就是药品价格相对昂贵,经济发展较差地区难以负担。2005-2019年间已有55种生物类似药在欧盟(EU)市场获得批准,其中包括生长激素、促红细胞生成剂(ESA)、粒细胞集落刺激因子(G-CSF)和单克隆抗体。欧洲药品管理局(EMA)于2010年3月允许批准符合FDA许可的原研药的生物类似药。2015年9月,FDA批准了美国第一个生物类似药,Sandoz公司的filgrastim(Zarxio®)。2016年4月,FDA批准了第一个生物类似药单克隆抗体,Celltrion公司的英夫利昔单抗(Inflectra®)。2019年2月国内首个上市生物类似药汉利康(利妥昔单抗)(复宏汉霖)获批上市。下表为国内生物类似药上市情况及药物名靶点。
1.专利方面的挑战
生物类似药主要挑战之一是专利问题。即使基本生物分子专利(主要专利)已经过期,但由于存在有效的二级专利,生物类似药的开发不得不推迟。二级专利主要是现有活性成分的新处方、生产工艺、新适应症以及活性成分的新组合相关的专利。处方专利是一种重要的药品生命周期管理策略,用于在原始专利到期后保持市场独家性。即使主要专利已过期,公司仍然可以通过获得处方专利来保持市场独家经营权。截至2021年12月,FDA已批33种生物类似药,其中只有22种在市场上市。可见由于二级专利的保护,生物类似药批准后上市使用仍然有限。为了避免侵犯这些专利,生物类似药开发公司可以利用原始处方开发替代处方,相应的代价就是牺牲时间和成本。此外还要考虑例如分子专利到期与处方专利之间的时间间隔等问题,避免侵犯二级专利,合理安排项目时间表。
2.单克隆抗体生物类似药开发
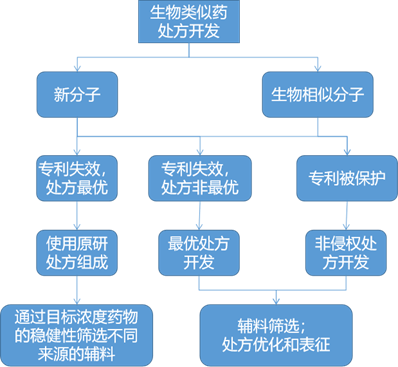
处方开发主要目标是为蛋白质分子提供一个稳定的环境,使其在整个生产、运输、储存和使用过程中保持稳定。对于新的分子,产品开发需要经历初步的风险评估--识别和降低风险--稳定的处方和工艺开发。
单克隆抗体(mAB)可能具有与化学和物理不稳定性。最常见的化学降解途径是氧化和脱酰胺,其次是异构化、去糖基化、糖基化、碎片化和交联。甲硫氨酸、半胱氨酸、组氨酸、色氨酸和酪氨酸等易感氨基酸的氧化会影响单克隆抗体的结构完整性、构象稳定性、安全性和有效性。为了减少蛋白质氧化,可以在处方开发过程中评估抗氧化剂的添加情况,例如甲硫氨酸、EDTA(乙二胺四乙酸)和二乙烯三胺五乙酸(DTPA)。此外通过惰性气体(氮气)来去除顶空氧气可能有效防止氧化。
聚集是生物药物产品中最常见的物理不稳定性,尤其是单克隆抗体(mAB),会直接影响药物的疗效和安全性。在分子的重新设计过程中,尽量识别和减少蛋白质中的易聚集区(APR)。约15%FDA批准的抗体药物具有至少一个APR。屏蔽APR的处方成分有助于减少聚集。通过与蛋白质疏水表面竞争,添加聚山梨醇酯(PS)80和PS20等非离子表面活性剂可以保护蛋白质免受搅动引起的聚集。
生物类似药处方开发需选择以及生产优质分子,即使处方不同,也要保证理化性质和生物活性特征与原研药高度相似。生物类似药处方开发取决于多种因素,例如专利、现有处方的改进空间、公司平台知识等。
3.最优处方开发思路:
处方设计主要依据先验知识和经验,黄金原则是组成尽量简单。限制于处方开发的时间和经济成本,已上市的抗体药物中仅使用了30种辅料(FDA已经批准1758种),有18种出现在十多种产品中。
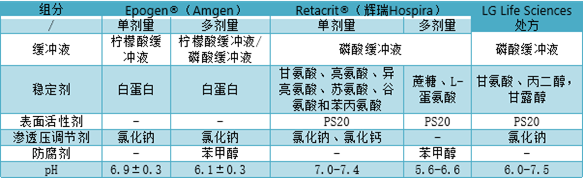
人血清白蛋白(HSA)很早就被用作疫苗和重组蛋白处方的赋形剂和稳定剂。HSA是血浆衍生产品导致其安全性一直受到监管机构重视。Amgen公司的Epogen®(Epoetin alfa)处方均以HSA作为稳定剂。多剂量处方加入苯甲醇有导致局部蛋白质区域展开的风险,这会增加蛋白质聚集并吸附到容器壁从而影响药物的疗效。为了防止这种情况,Epogen®使用含有等离子体衍生的HSA,减少蛋白的聚集,Amgen公司已申请含HSA的二级专利(已于2015年到期)用以保护其市场份额。因此,生物类似药处方开发将HSA替换为其他更优的稳定剂。
Bioceuticals公司开发出了不含HSA促红细胞生成素处方,该处方含有氨基酸(甘氨酸、亮氨酸、异亮氨酸、苏氨酸、谷氨酸和苯丙氨酸)、络合剂(氯化钙)、渗透压调节剂(氯化钠)、磷酸盐缓冲液和表面活性剂(PS20)。因此Bioceuticals公司也与辉瑞公司Hospira签订了独家协议,在美国和加拿大开发、生产和销售促红细胞生成素,Retacrit®(Amgen公司Epogen® 和Procrit®(epoetin alfa)的生物类似药)。Retacrit® 是美国市场上第一款获得批准的Epogen®生物类似药。LG Life Sciences 则使用协同组合稳定剂开发出一种稳定的促红细胞生成素处方,其处方成分为:磷酸盐缓冲液、丙二醇、甘氨酸、氯化钠和PS20。各处方信息如下表。
4.非侵权/可替换处方开发思路:
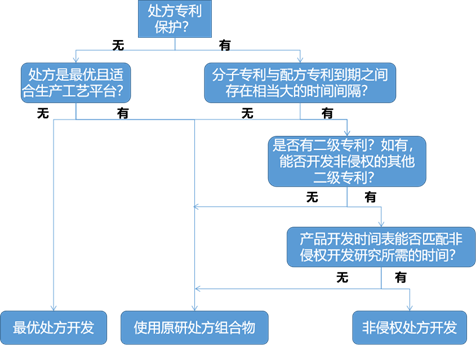
生物药产品的处方很复杂,在开发非侵权替代处方时必须考虑多个变量,这些变量包括分子专利到期与处方专利到期之间的时间间隔、不侵犯其他二级专利以及合理安排项目时间表。生物类似药的开发难点在于工艺、处方和特殊器件的有效二级专利的复杂性。原研公司会利用不同的策略来阻碍生物类似药和后续生物制剂的申报上市,这些策略可能包括为有偿延迟、专利和解、产品更新和收购竞争对手等。处方专利和产品更新是基于处方延迟生物类似药竞争的方法。产品更新是原研公司在现有处方基础上研制新处方,从而提高治疗效果或患者依从性,使到期的专利处方转向新处方。因此生物类似药产品开发的第一步是审查有关分子、工艺和药物产品的知识产权。非侵权处方开发需要来自各方面(知识产权、处方工艺、产品开发和项目管理)的意见。决策如图所示
阿达木单抗(Humira®)(用于治疗类风湿性关节炎)的主要专利分别于2016和2018年在美国和欧洲到期。但AbbVie公司拥有200多项与该药物的处方和生产过程相关二级专利(“专利丛林”),这使其能够在2023年之前保持其作为该行业垄断地位。AbbVie 与部分生物类似药研发公司签署了许可协议,允许他们于2023年1月后推出产品,因此2023年1月前AbbVie在主要市场仍然拥有垄断地位。
除了处方专利外,AbbVie还拥有与类风湿关节炎和炎症性肠病的剂量方案相关的次要专利。这种对处方和剂量专利侵权的不确定性导致生物类似药研发公司对AbbVie提起了多项诉讼。
Humira®首个上市处方为:甘露醇、氯化钠、PS 80、柠檬酸盐、磷酸盐缓冲液和50 mg/mL阿达木单抗。最新处方为:甘露醇、PS 80、磷酸盐缓冲液和100 mg/mL阿达木单抗。目前批准的生物类似药均是以50mg/m LHumira®为参考处方进行开发的。
开发替代处方需要筛选不同的缓冲液和稳定剂等辅料,从而使其与原研药相比,具有相似或更好的稳定性。CoherusBiosciences公司的处方筛选研究发现组氨酸-组氨酸琥珀酸缓冲液在 pH 5.2 ± 0.2 时处方具有较好的稳定性。稳定剂筛选结果显示,山梨糖、海藻糖、甘露醇对处方稳定性影响相近,而甘氨酸和精氨酸对阿达木单抗稳定作用较甘露醇更好。通常情况,氯化钠在较高浓度下会降低蛋白稳定,但当氯化钠的水平控制在100 mM以下时,氯化钠对处方具有稳定作用。与其他表面活性剂相比,PS 80 对处方具有较好的热稳定性,冻融和搅拌对选定处方稳定性几乎没有明显影响。2021年12月,FDA批准了Coherus Biosciences的生物类似药 Yusimry™。Yusimry™ 的处方为:甘氨酸、PS 80、氯化钠、组氨酸缓冲液和 50 mg/mL adalimumab-aqvh。

单克隆抗体(mAB)开发替代处方的过程,为了避免侵犯与处方相关的专利,选择辅料是一个极其重要的步骤。通常筛选已普遍认为安全的赋形剂(GRAS),并验证其对特定给药途径的适当限值。
5.生物类似药处方开发要点:
生物类似药开发的早期阶段需要思考拟定的生物类似药产品的处方是否可以与原研产品不同。FDA关于“生物类似药开发和BPCI法案的问答” 的行业指导文件指出,只要生物类似药申请人能够证明这两种产品在安全性、纯度和效力方面没有临床意义的差异,拟议的生物类似药和原研药之间的其他差异是可以接受的。截至2021年12月,28种生物类似药产品(不包括胰岛素生物类似药)已在美国获得批准,50%的获批生物类似药产品至少具有一种与原研产品不同的处方属性。说明生物类似药在符合安全性、纯度和效力要求的前提下,其处方是可以与原液产品不同。
贝伐珠单抗(bevacizumab)原研产品为Genentech公司的Avastin®,处方组成为海藻糖、磷酸缓冲液、PS 20和贝伐珠单抗。已批准生物类似药有Mvasi® 和Zirabev™,Amgen公司的Mvasi®具有与原研药Avastin®(Genentech公司)相似的处方成分,有两种规格(100 mg/4 mL 和 400 mg/16 mL,单剂量)。辉瑞的生物类似药Zirabev™ 与原研药相比,其处方成分(包括pH)完全不同,处方由蔗糖、依地酸二钠 (EDTA) 、琥珀酸盐缓冲液 (pH 5.5和PS 80 组成。Mvasi® 和 Zirabev™ 的容器封闭系统和原研产品 Avastin®均由西林瓶、橡胶塞和带铝盖组成。
贝伐珠单抗(bevacizumab-bvzr)的Fucosylation(岩藻糖基化)、terminal gal-actosylation(terminal gal- actosylation)和mannose(甘露糖基化)含量决定其物理和体内活性性质,抗体岩藻糖基化与效应活性有关,甘露糖含量会影响产品的药代动力学(PK),半乳糖水平会影响补体依赖性细胞毒性(CDC)活性。因此,强制降解研究,将其作为评估不同候选产品的可生产性、处方开发、方法开发、资格认证和转让、确定关键质量属性和可比性评估的工具。在生物类似药开发中,需要暴露于包括高温、光照和过氧乙酸条件下进行比较性强制降解研究,以证明生物类似药与原研药具有相似的降解特征(美国和欧盟 Avastin® 批次中都观察在高温条件下,贝伐珠单抗形成聚体和片段,倒置该药物失去了效力)。处方基质不同,生物类似药产品的降解速率也可能不同。
脱酰胺涉及从氨基酸残基中去除酰胺基团(-NH2),从而形成天冬氨酸残基的新化学基团。CDR 区域(或互补性决定区域)是mAb分子中参与与靶分子(例如致病蛋白)结合的特定部分。这些区域对单克隆抗体的治疗活性至关重要,其结构的任何变化都可能影响单克隆抗体与其靶标结合的能力。高pH条件可能导致mAb分子的CDR区域发生脱酰胺。可能发生在生产过程中或单克隆抗体产品的存储过程中。
冻融过程会导致非共价聚集,从而影响药物的质量。聚集程度取决于溶液的pH值和缓冲液浓度。研究显示当温度从+25°C降至-30°C时,磷酸盐缓冲液的pH值下降幅度最大(3.6个单位)。相比之下,其他缓冲液,如盐酸组氨酸、醋酸钠、醋酸组氨酸、柠檬酸和琥珀酸盐的pH增加小于1。因此,建议在选择替代缓冲液或稳定剂的同时进行冻融研究,以避免非共价聚集。在决定对生物类似药产品使用不同的 pH/缓冲剂系统时,应考虑降解的pH值依赖性差异及其对安全性和有效性的影响。
蔗糖和海藻糖是液体和冻干处方中常用的稳定剂。在酸性条件下,尤其是pH低于5,海藻糖是一种比蔗糖或棉子糖更有效的稳定剂。这是因为蔗糖和棉子糖的水解为还原糖的速度比海藻糖更快,更容易导致还原糖引起的降解。蔗糖和海藻糖在冻干产物中保持无定形状态,不会与蛋白质分子相分离,因此冻干制剂通常选择蔗糖和海藻糖作为稳定剂或冻干保护剂。在生物类似药处方中选择替代稳定剂时,重要的是要考虑与药物的储存方面的相容性,必要时要求类似药与原研药处方相当或具有更好的稳定性。
聚山梨酯是相容性较好和低毒性的表面活性剂。但是,它们实际上是不稳定的,会发生氧化和水解,通常水解速率比自动氧化的速度慢。PS80和PS20的降解方式不同,PS80更容易氧化,而PS20更容易水解形成颗粒;研究发现与含有PS 20的处方相比,含有PS 80的溶液性处方过氧化物含量更高。水解途径导致形成难溶的游离脂肪酸,从而形成可见和亚可见的颗粒。
6.发展趋势
2020年中国生物类似药市场规模达到3870亿元,全球生物药研发投入约为1610亿美元,其中中国生物药研发投入约为470亿元,占全球的比例约为23%。未来,随着政策支持和市场需求的增加,生物类似药的研发投入将继续增加。与原研药相比生物类似药的审批流程较为简化,审批速度相对较快,同时《生物类似药研发与评价技术指导原则》等政策的出台也为生物类似药的审批提供了有力保障。未来,随着监管体制的不断完善和技术的不断进步,生物类似药的审批速度将会进一步加快。目前,国内已经获批上市的生物类似药品种较少,但随着技术的不断进步和政策的不断支持,未来生物类似药的品种数量和质量将会不断提高,同时产品线的丰富度也将会不断增加。
参考文献:
【1】https://www.accessdata.fda.gov/drugsatfda_docs/nda.
【2】Deechongkit S, Aoki KH, Park SS, Kerwin BA. Biophysical comparability of the same protein from different manufacturers: a case study using Epoetin alfa from Epogen and Eprex. J Pharm Sci. 2006 Sep;95(9):1931-43. doi: 10.1002/jps.20649. PMID: 16850392.
【3】Goli VAR, Butreddy A. Biosimilar monoclonal antibodies: Challenges and approaches towards formulation. Chem Biol Interact. 2022 Oct 1;366:110116. doi: 10.1016/j.cbi.2022.110116. Epub 2022 Aug 23. PMID: 36007632.
【4】Jones GH, Carrier MA, Silver RT, Kantarjian H. Strategies that delay or prevent the timely availability of affordable generic drugs in the United States. Blood. 2016 Mar 17;127(11):1398-402. doi: 10.1182/blood-2015-11-680058. Epub 2016 Jan 27. PMID: 26817958; PMCID: PMC4915805.
【5】Bjelošević M, Zvonar Pobirk A, Planinšek O, Ahlin Grabnar P. Excipients in freeze-dried biopharmaceuticals: Contributions toward formulation stability and lyophilisation cycle optimisation. Int J Pharm. 2020 Feb 25;576:119029. doi: 10.1016/j.ijpharm.2020.119029. Epub 2020 Jan 15. PMID: 31953087.
【6】https://biosimilarsrr.com/biosimilars-reviews-reports.
【7】https://www.accessdata.fda.gov/scripts/cder/daf/.
<END>












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论