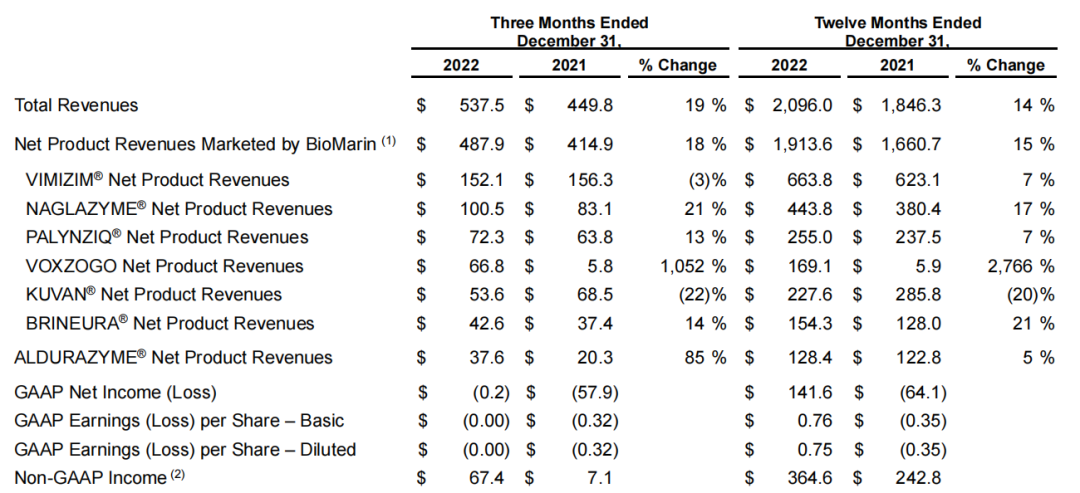
近期,罕见病龙头公司BioMarin Pharmaceutical Inc.(拜玛林制药公司)发布财报:2022年总收入达到21亿美元,同比增长14%;研发费用支出6.5亿美元,同比增长3%;净利润1.42亿美元,扭亏为盈。目前公司已经有8个商业化产品,主要以治疗罕见病为主,前三大产品去年销售情况如下:
Vimizim去年营收6.64亿美元,同比增长7%。该药物于2014年2月获得FDA批准,用于治疗粘多糖贮积症IVA型(Morquio A综合征),Vimizim是美国FDA批准的首个Morquio A综合征治疗药物。2019年6月Vimizim(中文商品名:唯铭赞)在中国获批,该药是国内首个黏多糖贮积症治疗药物。
Naglazyme去年营收4.43亿美元,同比增长17%。该药物于2005年获批上市,用于治疗粘多糖增多症VI (MPS VI)。MPS VI一种罕见的遗传代谢疾病,该病幼年即开始发作,患者表现为生长迟缓、身体组织受损和智力障碍。该疾病由于体内缺乏N-乙酰半乳糖胺-4-硫酸酯酶所引起的。Naglazyme通过酶替代疗法能够有效的缓解症状。
第三大产品Palynziq去年营收2.55亿美元,同比增长7%。该药物2018年5月获得FDA批准上市,用于治疗苯丙酮尿症(PKU)成人患者。
BioMarin未来颇具看点的是基因疗法Roctavian。2022年8月24日,欧盟批准Roctavian (Valoctocogene roxaparvovec)基因疗法的有条件上市,用于治疗体内不含凝血因子VIII抑制物和腺相关病毒5(AAV5)抗体的重度A型血友病成人患者。2023年3月6日,BioMarin公告,FDA确定提交正在进行的ROCTAVIAN第3期GENEr8-1研究的三年数据分析构成了一项重大修订,因为有大量额外数据,并将新的PDUFA目标行动日期定为2023年6月30日。第三阶段研究包括134名参与者,是迄今为止最大的血友病基因治疗研究。
截图来源:药融云全球药物研发数据库
去年底,FDA批准了全球首个针对重度和中重度血友病B的基因疗法——Hemgenix(etranacogene dezaparvovec)。Hemgenix的标价为每次使用350万美元,创下了最昂贵的一次性基因疗法的新纪录。Roctavian,适用于严重的血友病A,价格预计约为250万美元。
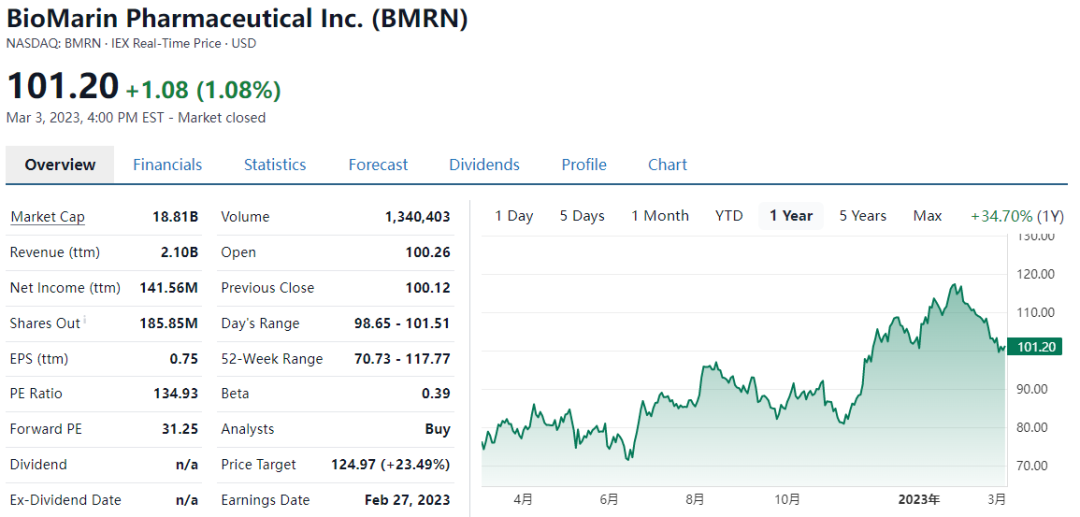
近一年BioMarin (Nasdaq: BMRN)股价涨幅超过30%,目前市值188亿美元(约1300亿人民币)(1.00美元=6.93 人民币)。
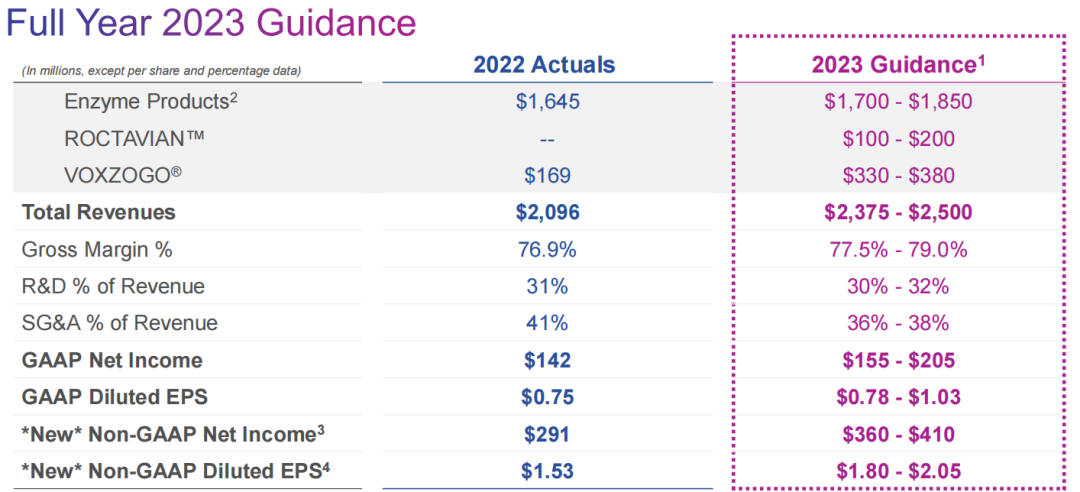
公司预计2023年总收入增长超过15%,净利润增长约30%;核心产品VOXZOGO的收入预计将增加一倍以上。基因疗法ROCTAVIAN(valoctocogene roxaparvovec)在2023年收入指导范围1到2亿美元(7亿到13.88亿人民币)。
BioMarin在其治疗严重血友病a的综合基因治疗项目中有多项临床研究正在进行中,除了全球3期研究GENEr8-1和正在进行的1/2期剂量增加研究外,该公司还在进行一项3期单臂开放标签研究,以评估valoctocogene roxaparvovec在6e13 vg/kg剂量下与预防性皮质激素联合应用于严重血友病a患者的疗效和安全性(研究270-303)。
BioMarin的研发管线
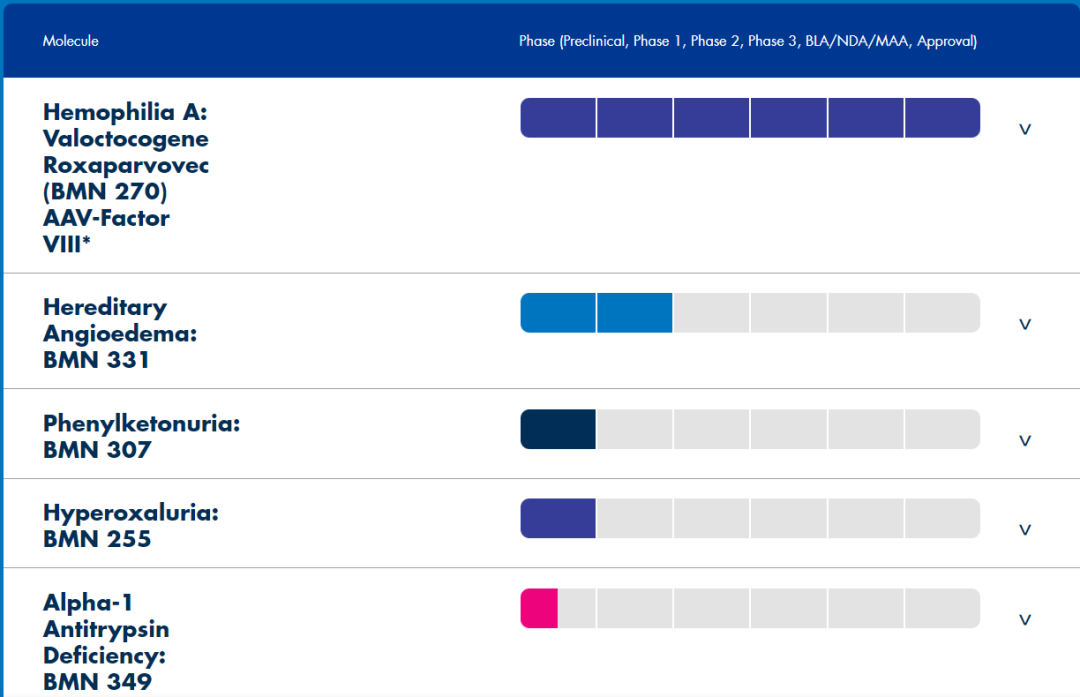

正在进行的还有一项1/2期研究,在存在AAV5抗体的严重血友病a患者中使用6e13 vg/kg剂量的valoctocogene roxaparvovec(研究270-203),以及一项1/2期研究,在存在活性或先前存在因子VIII抑制剂的严重血友病a患者中使用6e13 vg/kg剂量的valoctocogene roxaparvovec(研究270-205)。

BioMarin成立于1997年,是一家致力于通过基因发现改变生活的全球性生物技术公司。该公司开发并商业化靶向治疗,解决遗传疾病的根本原因。BioMarin强大的研发能力已经为罕见遗传疾病患者带来了多种创新的商业疗法。该公司独特的药物研发方法已经产生了多种商业、临床和临床前候选药物,解决了重大的未满足的医疗需求。
参考资料:
[1] 药融云数据库
[2] BioMarin官网:https://investors.BioMarin.com
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论