

口香糖已有几十年的历史,但很少作为药物递送系统使用。口香糖作为药物递送系统应用引起了制剂研发者的兴趣。载药口香糖(Medicated chewing gums,MCG)可以装载各种不同的API,这些API可以用于口腔的局部作用或通过口腔黏膜/胃肠道吸收后全身起效。欧洲药典将MCG定义为“以口香糖为主要成分的固体单剂量制剂,主要是咀嚼而不是吞咽”。美国药典和日本药典强调了MCG作为药物递送系统的应用。与其他口服固体制剂相比,MCG中API的释放主要是由患者的咀嚼触发的,并且有机会通过将MCG从口腔中取出来终止释放。咀嚼过程主要是为药物释放提供新的释放表面。与经典的口服固体制剂不同,咀嚼是药物从口香糖中持续释放的先决条件。
此外,生产工艺(熔融/挤出、直压)不同于其他固体制剂的生产工艺。通过直压生产的口香糖片剂,其成胶行为受载药量的影响。此外需要明确区分口香糖、咀嚼片和咀嚼凝胶。与口香糖不同,咀嚼片是在咀嚼或压碎后吞服,这也适用于咀嚼凝胶和咀嚼软胶囊。
MCG可用于装载局部或全身起效的API。API从整个口腔黏膜的吸收,不仅直接进入体循环,同时避免了首过效应。药物一旦从MCG中释放出来,唾液就充当口腔中的生物相关的溶出介质。唾液主要由水(99.5%)、相对较小百分比的蛋白质(作为表面活性剂或消化酶)以及钠离子、氯化物和碳酸氢盐组成。唾液组成和pH值以及分泌量是个体和个体间高变异的基础,并且取决于多个因素,例如患者的健康状况、年龄和性别,以及口香糖的适口性等。
重点关注口腔的生理条件和体内咀嚼行为,应设计MCG的体外性质检测,以研究在可重复条件下口香糖中API的释放。在欧洲药典中收载了两种用于MCG体外释放测试的药典设备,可用于质量控制或产品开发。USP中未收载口香糖一般性章节,但收载了关于Nicotine polacrilex口香糖专论。MCG的产品性质检测在USP的黏膜药物性质检测的通则中有简要提及,而对于其他信息(所用设备)并未提及,可以参考欧洲药典的相应章节。此外日本药典没有涉及MCG放行检测的其他信息。
本文提供了关于MCG最先进的检测的信息,重点是影响体外和体内释放动力学的因素,以及其相关性。
MCG的监管要求
MCG的性质检测即“含药口香糖的溶出测试”,虽然并没有发生药品的溶解。由于递送系统保持不变并释放了药物,本文将使用“释放测试”来描述MCG的性质检测。
MCG质量检测通常与口服固体制剂的监管要求有关
由于MCG需要在体温下的水环境中被机械力激活来释放药物,因此检测设备需要模拟咀嚼过程。在ICH协调范围内,欧洲药典介绍了两种不同装置(闭环系统)(图1)。装置A,欧洲药典描述:有一个不透明的金属室、两个模拟咀嚼的水平振动活塞,用于模拟咀嚼和一个垂直活塞,用于释放期间将口香糖制剂固定在原位。如欧洲药典所述,装置B由一个双壁玻璃室组成,包含一个垂直振动活塞和一个带有可拆卸咀嚼口的固定旋转活塞。每次运行后,装置B的钳口都需要变化,并对其厚度和表面粗糙度进行鉴定,以确保结果的重现性。欧洲药典建议这两种装置在37℃±0.5℃下介质体积为20ml(pH6.0磷酸盐缓冲液)。此外,根据装置B的生产商信息,可以将体积增加的70ml,但不确定装置A是否可以增加介质体积。与装置A不同,装置B以紧凑的模块化设计在市场上销售。MCG的释放取6份样品,咀嚼频率为60次/min。建议进行多点释放测试或确定口香糖中剩余的API含量,以获得药物释放曲线,以API的释放百分比表示。
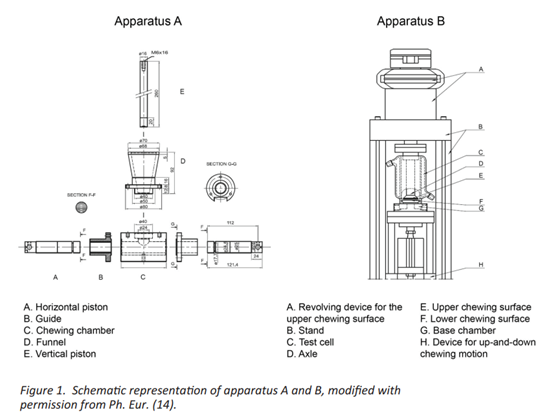
MCG的体外性质测定
影响药物释放的生理因素
咀嚼过程是复杂的生理机制,包括体内MCG释放API的主要部分,因此必须模拟预测体外测定。在咀嚼之前,给予的口香糖是固体,并且在加入到介质中时几乎没有任何释放。在通过咀嚼形成口香糖团块后,MCG被激活并在咀嚼作用下释放药物。机械力、温度、润湿性和水渗透率是影响制剂从固态转变为半固态的因素。通过牙齿揉捏口香糖,由于活化口香糖的可塑性和每次咀嚼期间施加的机械力,产生了新的药物释放表面。咀嚼频率是决定最大释放所需时间的关键参数,而API的总释放量取决于咀嚼次数。
唾液作为体内溶出介质,根据流速(唾液生成量)和组成分为刺激唾液和非刺激唾液。研究表明,未非刺激唾液pH范围为6.1~7.7。与非刺激唾液相比,刺激唾液的磷酸盐、蛋白质,特别是碳酸氢盐缓冲体系的浓度增加,这些缓冲体系引起更高的pH值。如Gitting等人检测了非刺激唾液和刺激唾液,发现非刺激唾液的pH值为6.5~7.3,刺激唾液的pH值为7.0~7.7,因此溶出介质也应进行分类,以反映口腔中的生理情况。体内唾液的缓冲能力也表现出较高的个体间差异,并且与pH值相似,刺激唾液的缓冲能力更高。发现人类非刺激唾液和刺激唾液流速在0.05-3.45ml/min范围内。高变异唾液流是由于唾液刺激受机械力、味觉、视觉和嗅觉的影响。所以口感和味道是患者依从性的重要参数,因此口感和味道也是释放的重要参数,因为口感和味道会影响唾液流速,这取决于所加入的矫味剂或甜味剂。咀嚼频率也是个体差异较大的参数,然而用不同的咀嚼频率的MCG显示唾液流速并没有变化。
影响药物释放的体外测试装置参数
体外检测设备的参数-咀嚼频率、钳口扭转角度和钳口距离-通常可以在37℃±0.5℃条件下进行参数调整。Gajendran等人给出了释放装置参数的一般建议。原则上,当咀嚼频率从40次/min增加到60次/min时,药物释放更快。药物释放量是咀嚼次数的函数。对于下颌距离,随着两个装置的距离按照以下顺序减小,药物释放量更高。装置A:0.7<0.5<0.3mm;装置B:1.8<1.6<1.4mm(图2)。装置B由于上活塞的旋转速度有限,不能使用高咀嚼频率和高扭转角。
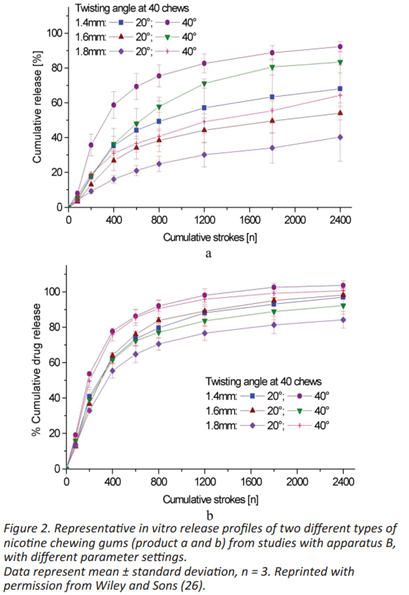
对于MCG体外释放方法的开发和验证,USP通则<1092>中描述的用于固体口服剂型的相同程序可以应用于缓释制剂。Marques等人提供了有关模拟唾液作为生物相关介质的组成和特性的更多信息。
这两种药典装置已纳入一项合作研究,在六个不同的实验室检测三种不同的尼古丁口香糖释放药物的准确度。发现没有普遍偏好一种设备,并且这些装置没有为特定的产品提供类似的结果。Gajendran等人比较了两种装置并得出结论:对于选定的药品,使用装置A时,在不同测试条件先不会产生有区分力的释放曲线;对于装置B,在所有情况下,不同的设定参数都可以反映在释放曲线上。
处方和生产对药物释放的影响
口香糖胶基作为MCG的主要成分,是一种疏水性聚合物的复杂混合物,主要负责活化状态下口香糖的独特性能。生产工艺不同,API从MCG中的释放动力学可能会发生变化。此外,发现辅料对MCG产生影响,尤其是芳香族化合物,因为芳香族化合物在患者依从性方面也发挥着作用。此外,由于在水性介质中的溶解度和疏水性化合物与口香糖基质相互作用,亲水性化合物从口香糖中释放的API增加,而疏水性药物则减少。对于口崩片、混悬剂和凝胶,已经定义了递送系统内颗粒的粒径以确保令人愉悦的口感。对于口香糖载药系统,文献仅报道了糖果产品中蔗糖颗粒的数据,优选粒径小于74μm的粒径。因此,对于每种口香糖处方,必须单独确定所容许的颗粒粒径。
IVIVC(体内外相关性)
USP将体外-体内相关性(IVIVC)定义为“在生物学特性或源自剂型产生的血药浓度的参数与同一剂型的物理化学特性或特征之间建立的合理的关系”。FDA将IVIVC定义为“描述缓释剂型的体外特性(通常是药物溶出或释放的速率或程度)与相关的体内反应之间关系的预测数学模型,例如血药浓度和药物吸收量”。在监管环境中,根据数据缩减的程度定义了三个级别的相关性。A级是优越的,使用完整的体外和体内分析数据。无需使用口服给药后血药浓度曲线的释放曲线的一般去卷积方法即可建立MCG的API释放的A级相关性(图3)。与崩解型口服制剂相比,口服制剂用药后不再可接触并在人体内分解,MCG可以在规定的时间间隔后从口腔中取出。之后,可以确定MCG中剩余的API含量,从而可以计算出API的释放量。有了这些体内信息,可以开发可预测的体外测试,即使释放的药量没有提供任何关于人体吸收的信息。使用这种方法,发现与反卷积方法相比,口香糖中尼古丁释放的IVIVC更具有预测性和准确性。然而,咀嚼频率是药物释放的关键参数,需在研究设计中设定咀嚼频率,并应进行监测。
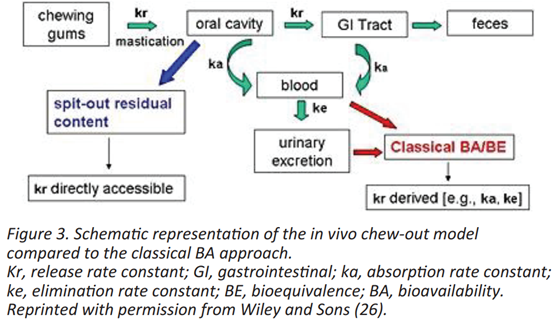
结论与展望
欧洲药典描述了两种用于MCG性质测定的药典装置,但USP并未收载此类方法。研究表明,实验室之间测定结果存在很大差异,并且迫切需要进行性质测定验证测试,因为这需要小心处理设备以获得有效数据。这可以解释为什么USP不收载此类方法。在不同实验室使用统一的机械鉴定程序和释放测试设备进行比较研究,之后应使用参考标准进行性能验证测试。此外,应仔细分析设备、操作人和处方对释放数据变异性的影响,以排除对释放影响的过度区分或不充分区分的可能性。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论