
爵士乐(Jazz)作为一种极富特色的音乐类型,其一大特点就在于集体的即兴创作,由此诞生的不仅是一种新的声音,而是一种新的表达形式。Jazz虽然总被视为小众音乐,但现代许多受欢迎的音乐类型却不可避免地受其影响。

艺术与科学存在许多一致之处。爱尔兰药企爵士制药‘Jazz Pharmaceuticals’名字的灵感就来源于爵士乐——每个爵士乐手都独具风格,但是大家聚在一起共同创作,整体的力量胜于部分之和……协作精神驱动一个充满创造性的团队齐心协力为一个共同目标努力:创新以改善患者及其家人的生活。爵士制药的logo设计貌似也是借鉴了唱片的样子。
爵士制药公司基本信息及投融资情况
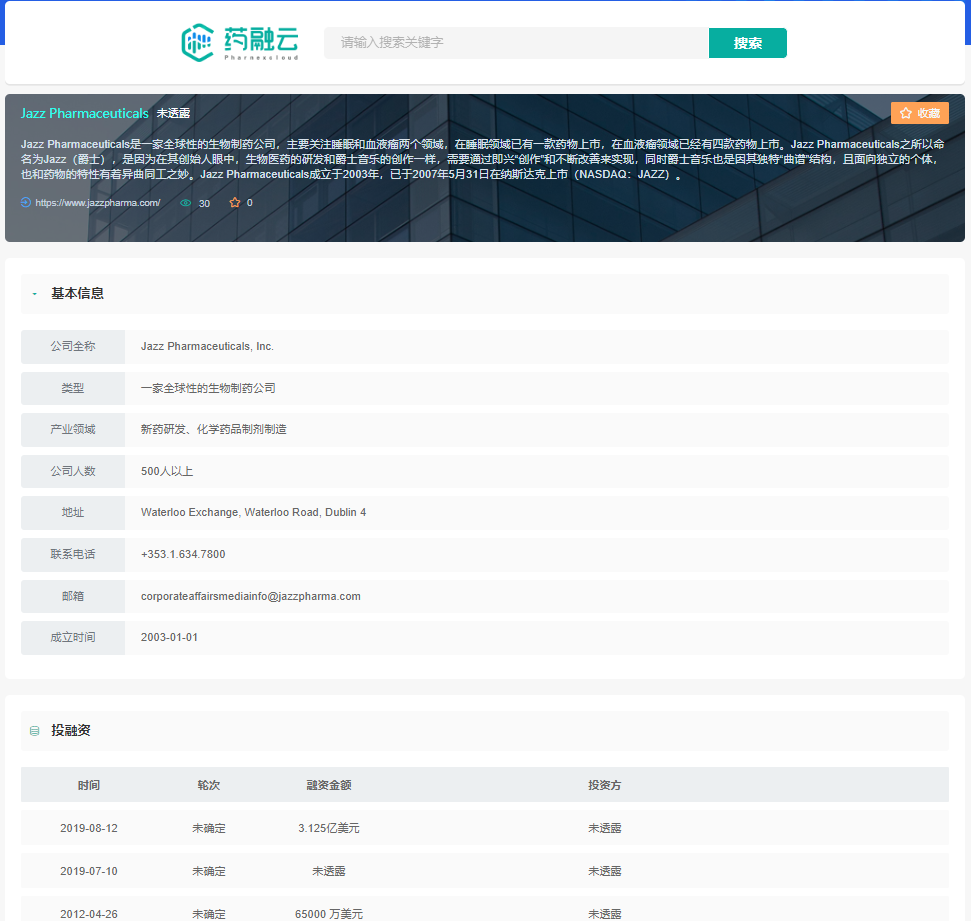
截图来源:药融云投融资数据库
爵士制药成立于2003年,已于2007年5月31日在纳斯达克上市(NASDAQ:JAZZ)。目前,爵士制药已成为一家完全整合的全球性生物制药公司,致力于为患有严重疾病的人群开发能够改变生活的药物,这些人群通常治疗选择有限或无药可用。公司拥有针对成人和儿童适应症的多种已上市药物和新型候选产品组合,并在神经科学和肿瘤学这两个关键治疗领域拥有专业知识,是治疗睡眠障碍和癫痫的行业领导者。在这些治疗领域,爵士制药积极探索小分子和生物制剂,并借助创新的递送技术和大麻素科学平台,开发新的治疗方案。
爵士制药在全球范围内拥有3100多名员工,在近75个国家/地区开展业务或合作,全球化的商业足迹和业务支持药物的迅速推出以及产品组合的拓展。
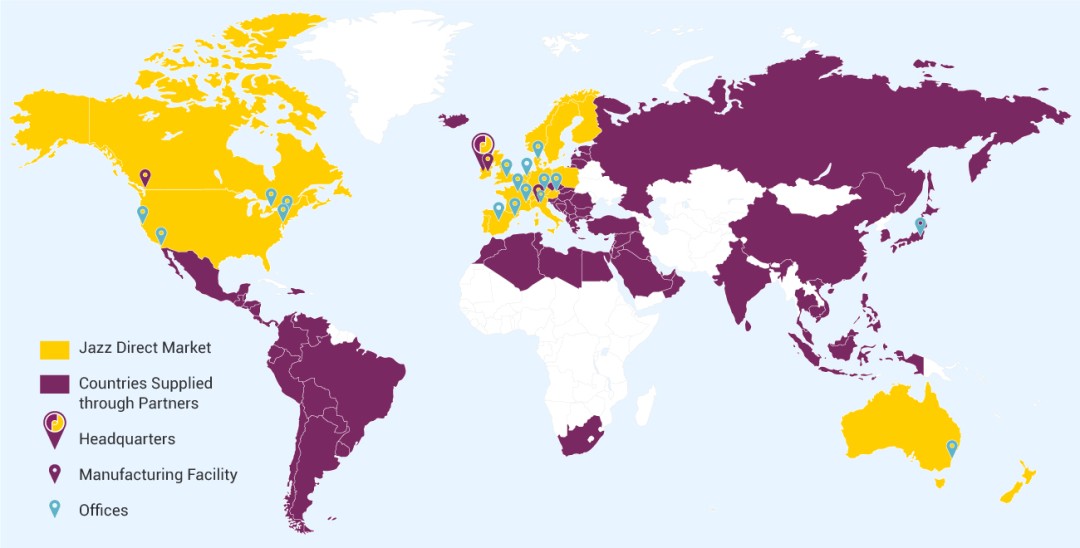
在2022年1月举办的第40届摩根大通医疗健康年会上,爵士制药宣布其2025年愿景:旨在实现可持续增长并提升价值,推动持续转型,成为创新、高增长的全球制药领导者。2025愿景的三个核心组成部分:商业执行、管线生产力和卓越运营。
爵士制药72亿美元收购大麻素药物领导者GW
在全球范围内,GW Pharmaceuticals无疑是大麻素药物的领导者,这家英国制药公司的主打产品Epidiolex(活性成分为大麻二酚;cannabidiol;CBD)是美国FDA批准的首个植物来源的大麻素药物。2021年,爵士制药以72亿美元收购,获得新型大麻素平台及其产品组合,以扩大神经科学领域资产。收购完成后,爵士制药在神经科学领域建立起强大优势,并进一步多元化其投资组合,创造可持续的长期价值。

GW市场地位较为特殊,因为美国对大麻素成分有严格管制,而GW已经说服监管部门取消了对Epidiolex配方的管制,但没有取消对CBD本身的管制。结果是,GW成为唯一合法销售CBD药物的厂商,尽管技术壁垒不高,但监管层面的原因,该公司在短期内面对的是一个没有竞品的市场。
已上市产品组合

经药融云数据库查询,爵士制药目前在全球范围内共有9款药物批准上市商业化。其中包括5款神经科学药物和4款肿瘤学药物。
爵士制药已上市产品信息
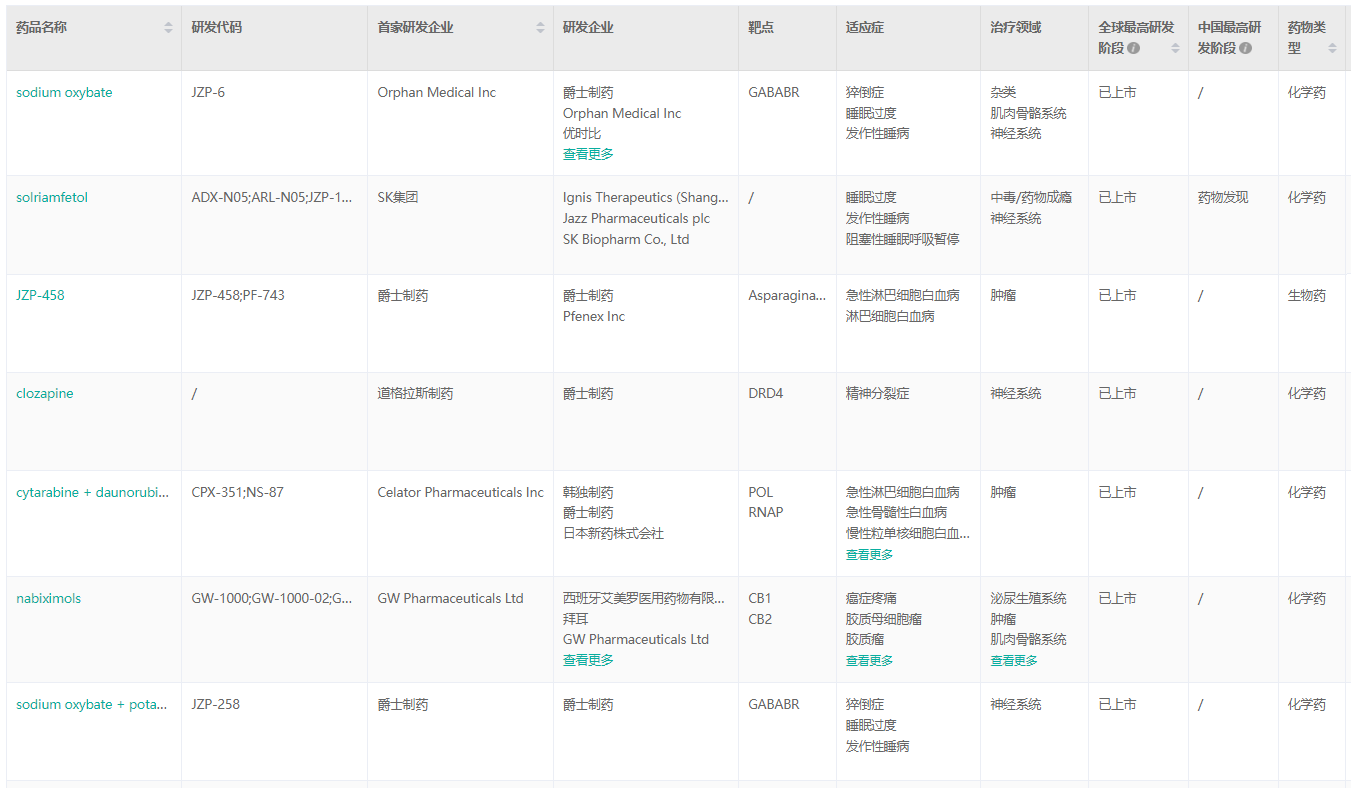
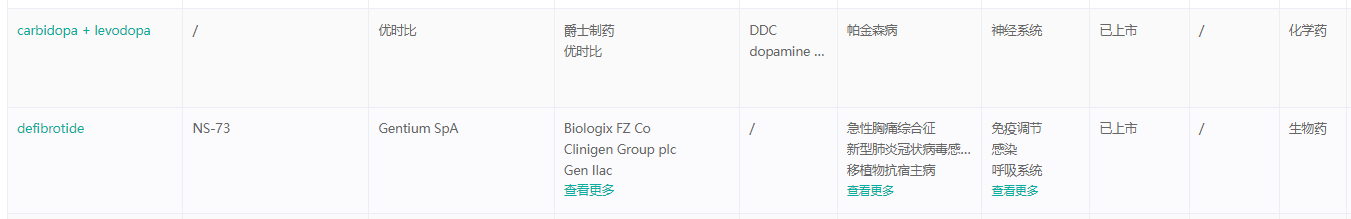
截图来源:药融云全球药物研发数据库
- 神经科学
• Xywav®(羟丁酸钙镁钾钠;calcium,magnesium, potassium, and sodium oxybates)口服溶液于2020年7月获美国FDA批准,2020年11月在美国上市,用于治疗7岁及以上发作性睡病患者的猝倒或日间过度嗜睡(EDS),并于2021年8月获FDA批准用于治疗成人特发性嗜睡症(IH),也是FDA批准的首个治疗IH的药物。同时,Xywav®具有独特的阳离子组分钙、镁、钾、钠,与Xyrem(羟丁酸钠)相比减少92%的钠含量,大大减少患者的慢性钠负荷。虽然Xywav的确切作用机制尚不明确,但其对猝倒和EDS的治疗作用被认为是通过对GABAB受体的调节,进而在睡眠时作用于去甲肾上腺素能神经元、多巴胺能神经元以及丘脑皮层神经元;
• Xyrem(羟丁酸钠;sodium oxybate)口服溶液已获得美国FDA批准并在美国销售,用于治疗7岁及以上发作性睡病患者的猝倒和日间过度嗜睡;在加拿大,Xyrem可用于治疗发作性睡病患者的猝倒。Xyrem还通过许可协议在欧洲、英国和其他市场获得批准和分销。该产品由爵士制药在2005年收购Orphan Medical而获得,是天然神经递质γ-羟基丁酸(GHB)的钠盐.;
•Epidiolex®(大麻二酚;cannabidiol)口服溶液由GW Pharmaceuticals开发,于2018年获美国FDA批准并推出,该药在美国目前可用于Lennox-Gastaut综合征(LGS)、Dravet综合征(DS)或结节性硬化症(TSC)相关的癫痫发作的1岁及以上患者(这三种均是罕见的、严重的、儿童期发病的药物难治性癫痫类型);在欧洲和其他市场,该药以Epidyolex®为品牌名进行销售,被批准用于Lennox-Gastaut综合征或Dravet综合征相关癫痫发作的2岁及以上患者的辅助治疗,或与氯巴占联合使用(仅限欧盟和英国),以及用于TSC相关癫痫发作的2岁及以上患者的辅助治疗。Epidiolex/Epidyolex是美欧批准治疗癫痫的首个植物来源的大麻素药物,也是首个新型抗癫痫药物(AED);
• Sunosi®(solriamfetol),是一款双效多巴胺和去甲肾上腺素再摄取抑制剂(DNRI),用于治疗发作性睡病(伴有或不伴有昏厥)或阻塞性睡眠呼吸暂停(OSA)相关的白天过度嗜睡(EDS)成人患者,在美国、加拿大、欧洲和英国获得批准并上市。2014年,爵士制药从Aerial BioPharma获得了solriamfetol除亚洲部分地区之外的全球开发和商业化权利。韩国SK生物制药是该化合物的发现者,并拥有solriamfetol在韩国、中国、日本在内的12个亚洲国家市场的权利。不过2022年5月,爵士制药已正式将Sunosi®(solriamfetol)资产剥离给了Axsome Therapeutics,根据协议条款,爵士制药将获得5300万美元的预付款,以及在当前和未来适应症中Sunosi美国净销售额的特许权使用费;
• Sativex®(nabiximols)口服溶液已在美国以外多个地区,如英国、加拿大和其他市场获得批准和销售,其口腔粘膜喷雾制剂是全球首个植物来源的大麻素处方药。该药由爵士制药从GW制药公司获得,用于改善多发性硬化症(MS)引起的中度至重度痉挛的成人患者的症状,这些患者对其他抗痉挛药物没有充分反应,且在nabiximols初始治疗试验期间表现出痉挛相关临床症状的显著改善。
- 肿瘤学
• Zepzelca®(鲁比卡丁,lurbinectedin)是一款海鞘素衍生物,为RNA聚合酶II的抑制剂,用于治疗铂类药物化疗后疾病进展的转移性小细胞肺癌(SCLC)成人患者,于2020年6月获美国FDA批准,同年7月在美国上市;在加拿大,Zepzelca于2021年9月获批用于治疗铂类药物化疗后疾病进展的III期或转移性SCLC成人患者。据了解,该药物是过去20多年来治疗小细胞肺癌的首个新化学实体,目前已被ESMO纳入SCLC的临床实践指南。其在美国和加拿大的权利由爵士制药从PharmaMar公司获得,在国内,绿叶制药拥有该药物在中国开发及商业化的独家权利,包括小细胞肺癌在内的所有适应症,并可要求PharmarMar进行该药物的技术转移,由绿叶制药在中国生产;
• Rylaze™(重组欧文氏菌门冬酰胺酶;recombinant Erwinia asparaginase)可作为多药化疗方案的组成部分,用于对大肠杆菌来源的门冬酰胺酶过敏的急性淋巴细胞白血病(ALL)或淋巴母细胞淋巴瘤(LBL)儿童和成人患者。据估计,20%的患者对标准大肠杆菌来源的门冬酰胺酶过敏。该产品已于2021年6月获美国FDA批准并于2021年7月在美国上市。NCCN已将该产品纳入急性淋巴细胞白血病(ALL)的肿瘤学临床实践指南。门冬酰胺酶可降解门冬酰胺,使肿瘤细胞缺乏门冬酰胺而生长受限;
• Vyxeos®(柔红霉素+阿糖胞苷;daunorubicin and cytarabine)是一款复方脂质体注射剂,由柔红霉素和阿糖胞苷两款药物组合而成,用于治疗相关的急性髓系白血病(t-AML)以及骨髓增生异常相关变化的AML(AML-MRC)。在加拿大、欧洲和英国,该产品被批准用于t-AML和AML-MRC成人患者,在美国,除成人患者之外,该产品还可用于1岁及以上儿童患者。这是首款针对特定类型AML的上市治疗用药物,由爵士制药在2016年收购Celator Pharmaceuticals获得,此次收购也使爵士制药获得Celator的CombiPlex®脂质纳米药物递送平台;
• Defitelio®(去纤苷钠;defibrotide sodium)是一种单链的多聚脱氧核糖核昔的钠盐,具有抗血栓,抗局部缺血,抗炎性反应和促纤维蛋白溶解的特性。该产品在美国和巴西获批用于治疗造血干细胞移植(HSCT)后出现肾或肺功能障碍的肝小静脉闭塞病(VOD),在日本用于治疗VOD,在欧盟、英国、加拿大、以色列、韩国、澳大利亚和瑞士被批准用于在HSCT过程中治疗严重的肝VOD,也称为窦阻塞综合征(SOS)的1个月及以上的成人和儿童患者。该产品由爵士制药于2014年收购罕见病药物开发商Gentium SpA而获得。
主要在研管线

▲爵士制药主要研发管线(更新至2022年5月)
除了上述产品之外,爵士制药正积极为患者探索新的治疗选择,包括新化合物、新型小分子、生物制剂和创新递送技术。公司的开发工作专注于神经科学和肿瘤治疗领域,向运动障碍和实体瘤适应症的扩展,并探索和潜在地投资于邻近的治疗领域。该公司开发活动涵盖所有阶段,包括新候选产品的临床试验,以及现有上市产品的适应症拓展等。此外,该公司还制定了积极的临床前开发计划,包括血液学和肿瘤学中的精准药物以及基于GW大麻素平台的产品。
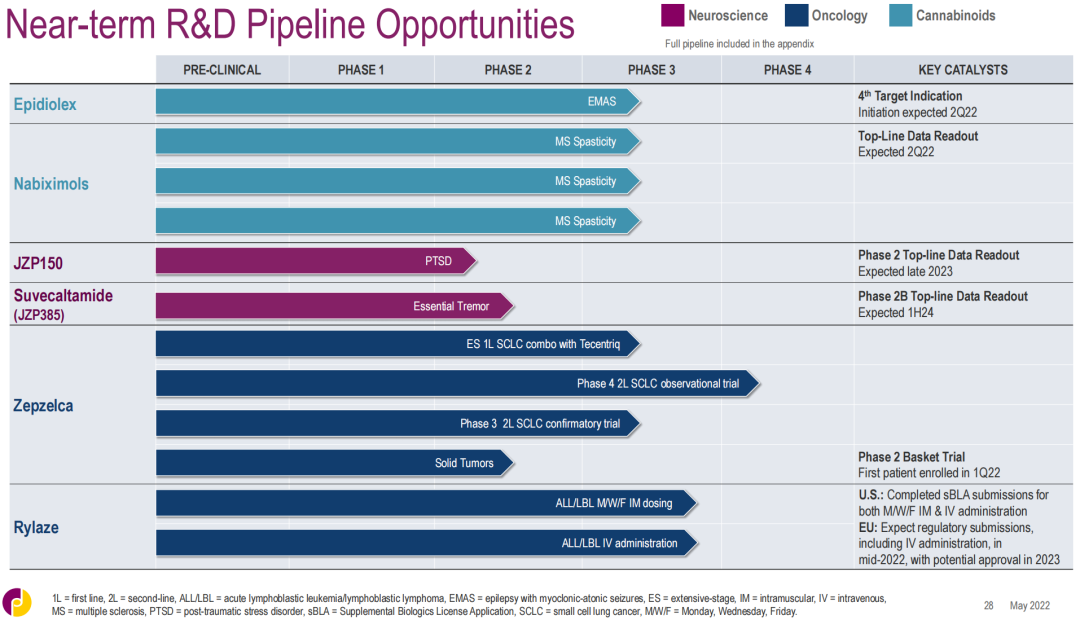
▲爵士制药主要临床阶段管线里程碑(更新至2022年5月)
- 神经科学
目前,爵士制药在神经科学领域的开发计划集中于拓展Epidiolex(大麻二酚;cannabidiol)的适应症,同时推进新治疗方案的开发。
对于Epidiolex(大麻二酚;cannabidiol),该公司计划在2022年上半年启动一项针对癫痫伴肌阵挛-站立不能发作(EMAS,也称Doose综合征)的关键3期试验,以提供Epidiolex在这种综合征类型中的第一个随机、对照临床数据。EMAS或将成为Epidiolex的第4项适应症。
对于nabiximols,爵士制药正在开展3项针对多发性硬化症(MS)相关痉挛的3期试验,旨在扩大关于nabiximols在改善MS患者痉挛症状方面的安全性和有效性证据。该产品是一种源自大麻的复杂混合物,含有四氢大麻酚(THC)和大麻二酚(CBD),以及其他特定的大麻素和非大麻素成分。该产品虽然已在英国、加拿大等地区上市,但还未在美国获得批准。若此次试验结果积极,或可支持该产品向美国FDA提交NDA申请,有望进入美国市场。公司还计划开展nabiximols用于脊髓损伤痉挛的3期临床试验。
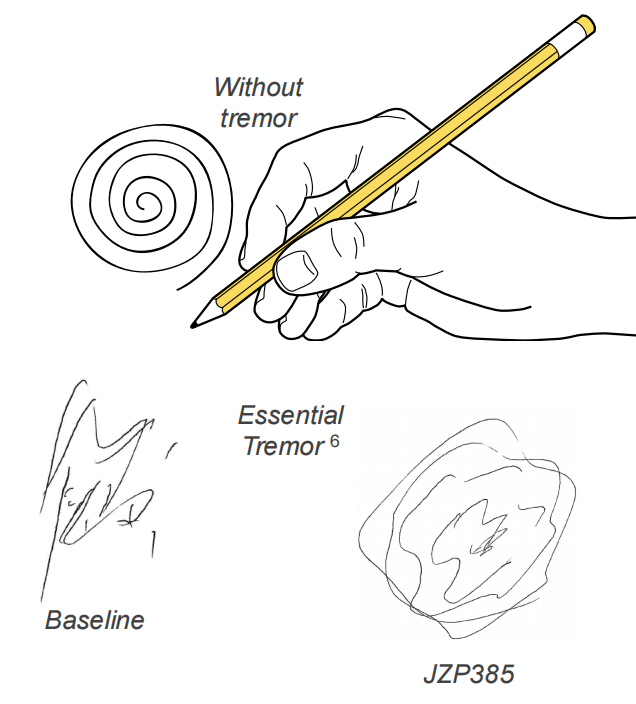
Suvecaltamide(JZP385)是一款高度选择性的T型钙离子通道调节剂,由爵士制药于2019年收购临床阶段生物技术公司Cavion而得。该产品被开发用于治疗特发性震颤(ET),该病是临床最常见的运动障碍性疾病,50多年来没有新获批的疗法。2021年12月,公司启动了suvecaltamide的2b期临床试验,以评估其治疗成人中重度ET的安全性和有效性。
JZP150是一款脂肪酸酰胺水解酶(FAAH)抑制剂,用于潜在治疗创伤后应激障碍(PTSD)及相关症状。该产品由辉瑞于2017年许可给SpringWorks Therapeutics,原研发代号PF-04457845,爵士制药于2020年向SpringWorks购得该产品的独家全球权利。PTSD影响多达8%的成年人,且治疗选择有限。药融圈旗下药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)显示,爵士制药于2021年12月启动了JZP150治疗PTSD的2期临床试验。
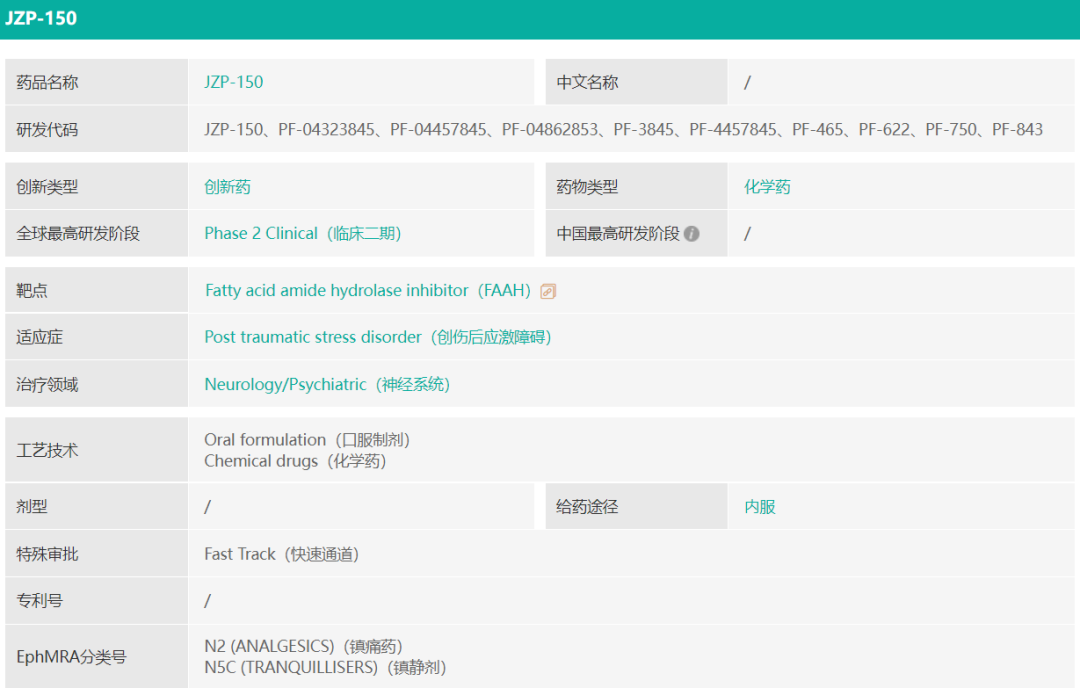
▲截图自药融云数据库
除此之外,该公司还在开展JZP324的早期开发工作,该产品是羟丁酸钠的缓释制剂,有望为发作性睡病患者提供具有临床意义的新治疗选择。
- 肿瘤学
公司在肿瘤治疗领域开展的研发活动主要集中在Rylaze(重组欧文氏菌门冬酰胺酶;recombinant Erwinia asparaginase)和Zepzelca(鲁比卡丁,lurbinectedin),包括与其他药物联用;探索Vyxeos(柔红霉素+阿糖胞苷;daunorubicin and cytarabine)的其他适应症,以及研发新的候选产品。
对于Zepzelca(鲁比卡丁,lurbinectedin),爵士制药正与罗氏合作开展一项关键3期临床试验,旨在评估该药与Tecentriq(阿替利珠单抗,atezolizumab)联合用于的一线治疗广泛期小细胞肺癌(SCLC)的效果。2022年第一季度,爵士制药启动了一项名为EMERGE-201的2期篮子试验,以探索Zepzelca单药疗法对部分晚期或转移性实体瘤患者的疗效,队列将包括晚期尿路上皮癌、肺大细胞神经内分泌肿瘤和同源重组缺陷(HRD)癌症。此外,该公司已经启动了一项4期观察性研究,以收集先前Zepzelca单药治疗铂类药物化疗后疾病进展的SCLC成人患者的真实世界安全性和有效性数据。
对于Rylaze(重组欧文氏菌门冬酰胺酶;recombinant Erwinia asparaginase),爵士制药在2022年1月向FDA提交了一份sBLA申请,其中包含支持周一/周三/周五(M/W/F)肌肉注射给药方案的数据,并于2022年4月提交了一份单独的sBLA用于支持静脉内给药,两者均已根据RTOR计划获得监管审查。该公司还计划在2022年年中在欧洲提交该药的肌肉注射和静脉注射给药的监管文件。
Vyxeos(柔红霉素+阿糖胞苷;daunorubicin and cytarabine)的开发计划主要针对急性髓系白血病(AML)领域的潜在新患者群体,并在与其他药物联用时生成有关Vyxeos的临床数据。针对该产品的进一步开发,公司主要与临床试验团体,以及德州大学MD安德森癌症中心等合作开展。
- 近期许可/合作开发项目
2022年4月,爵士制药宣布与Werewolf Therapeutics签订许可协议,以获得Werewolf的临床前在研候选产品WTX-613(现称为JZP898)的全球独家开发和商业化权利。JZP898是一种差异化的、条件激活的干扰素α(IFNα)INDUKINE™分子(Werewolf将其专有的PREDATOR平台研发出来的候选产品称为INDUKINE分子,其可在全身递送但仅在肿瘤微环境内部中激活,从而提供细胞因子抗肿瘤免疫活性的全部生物学效力并获得最大的治疗潜力,同时最大限度地减少细胞毒性)。根据协议条款,爵士制药向Werewolf支付了1500万美元的预付款,Werewolf有资格获得高达12.6亿美元的开发、监管和商业里程碑付款,以及未来JZP898净销售额的中个位数百分比的分层特许权使用费。
2022年5月,爵士制药宣布与日本住友制药签订许可协议,以获得住友制药的在研候选产品DSP-0187,一种强效、高选择性口服orexin-2受体(OX2R)激动剂,可用于治疗发作性睡病、特发性嗜睡症和其他睡眠障碍。爵士制药将该分子命名为JZP441。根据协议条款,爵士制药将向住友制药支付5000万美元的预付款,住友有资格获得高达10.9亿美元的开发、监管和商业里程碑付款,未来有资格从JZP441净销售额中获得低两位数的分层特许权使用费。
财务状况
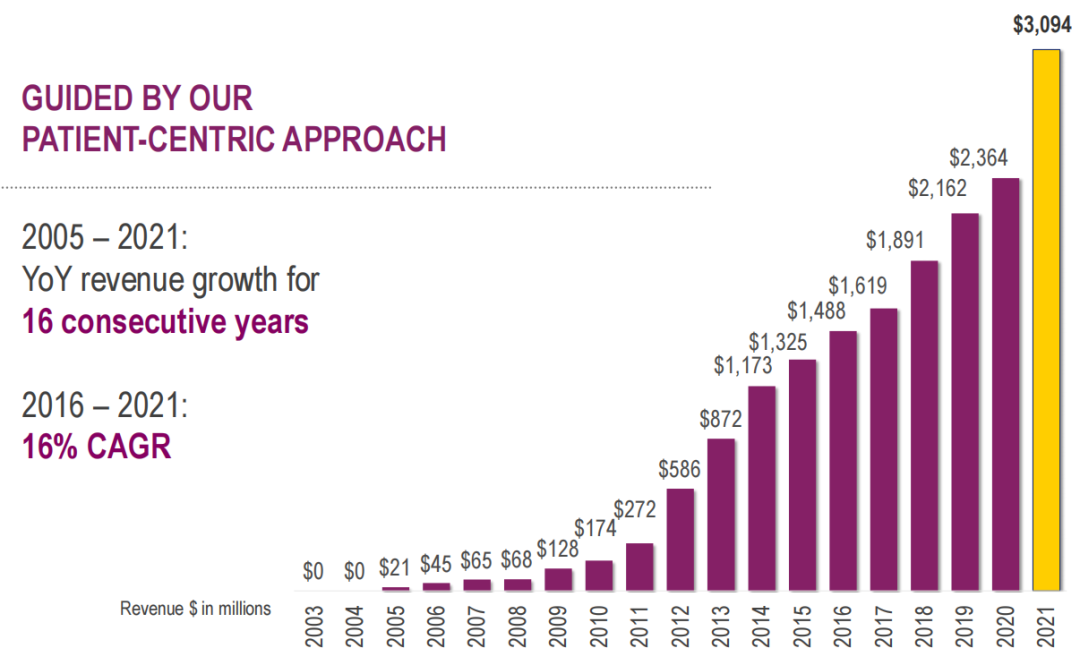
从2005年到2021年,爵士制药的业绩收入实现连续16年的增长,2016至2021年间,年复合增长率达16%。
爵士制药的对外收购以及近几年公司多款产品获得监管批准,使得该公司产品收入结构快速变化,下图为公司2015年和2021年产品收入结构的对比。在完成对GW制药的收购之后,其产品结构进一步实现多样化。
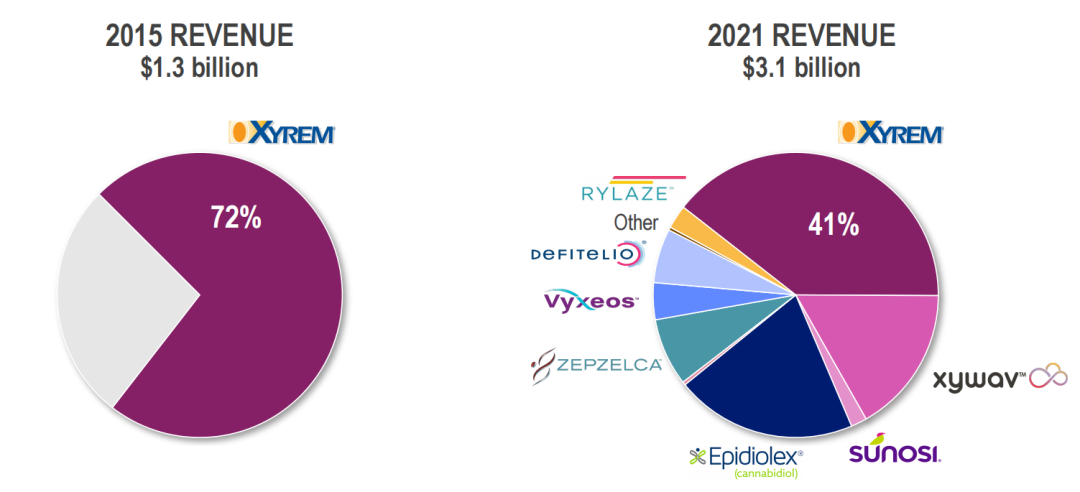
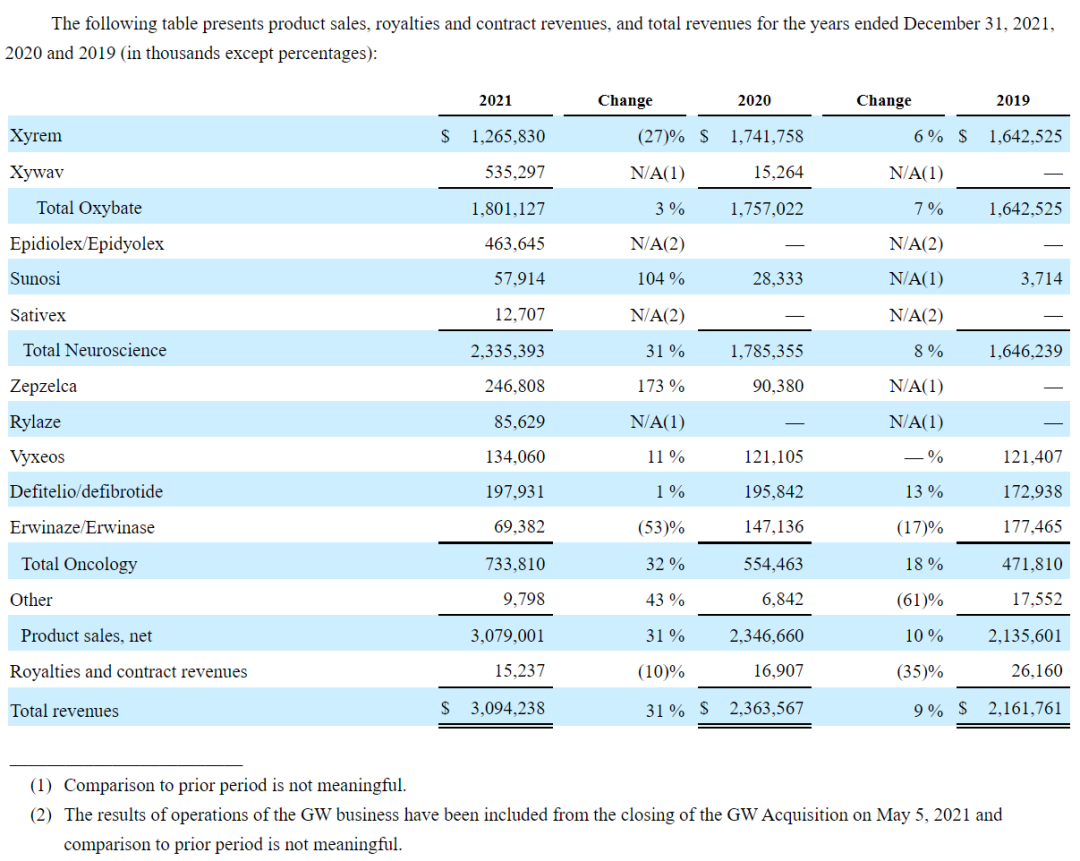
2021年,爵士制药全年总收入首次超过30亿美元,达到30.94亿美元,同比增长31%;全年研发支出5.06亿美元,同比增长51%;一般及行政开支14.52亿美元,同比增长70%。GW制药的业务自2021年5月5日收购完成后开始计入。近三年爵士制药各板块具体产品业绩分布情况如下图:
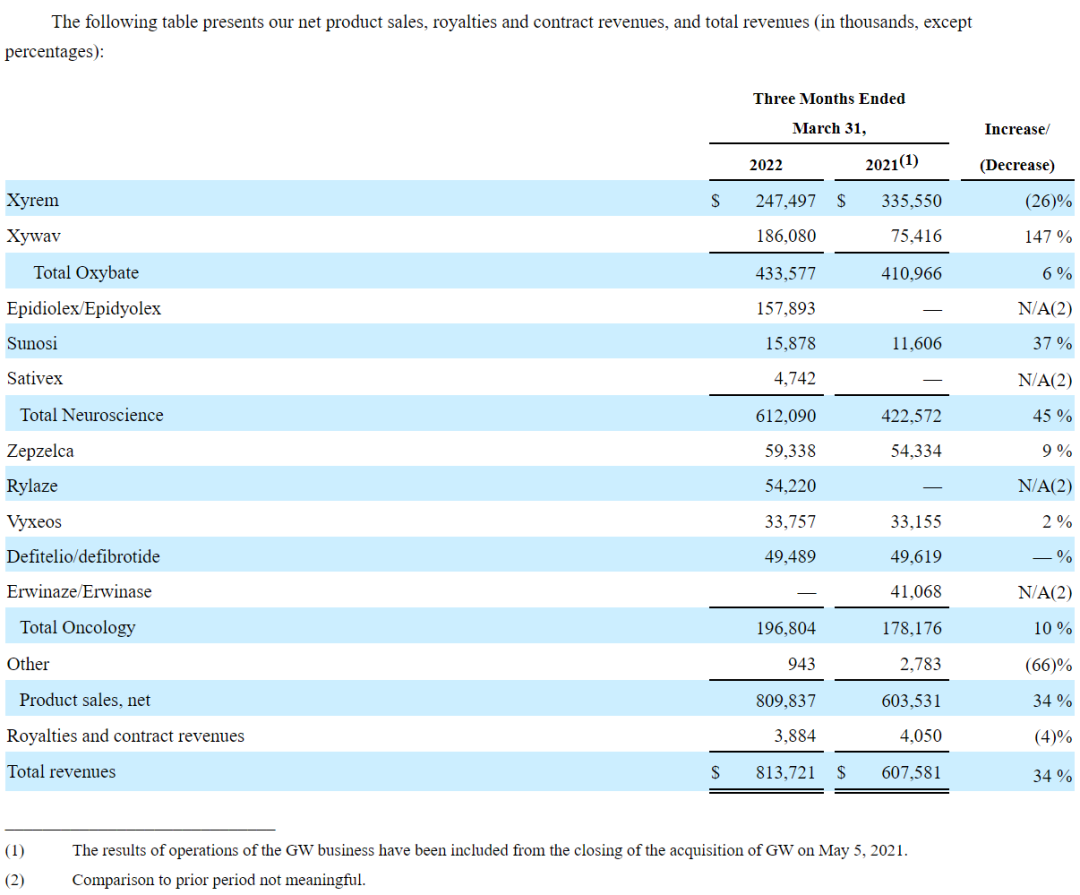
2022年第一季度,该公司总收入达8.137亿美元,同比增长34%;研发支出1.3亿美元,同比增长70%;一般及行政开支3.09亿美元,同比增长19%。各板块具体产品业绩分布情况如下图:
爵士制药预计2022年全年总收入将达到35~37亿美元。截至2022年3月31日,公司拥有现金和现金等价物共4.908亿美元。
爵士制药企业发展简史
爵士制药由BruceC. Cozadd博士联合创立于2003年。2005年,该公司收购Orphan Medical,将孤儿药Xyrem纳入其产品组合,后来成为爵士制药的旗舰产品。2007年,公司在纳斯达克上市(NASDAQ:JAZZ),但其股价开始一路下跌,到2009年3月,其市值不足3000万美元。于是该公司开始了战略重组,换掉CEO、裁员,并开始了Xyrem的提价策略,使该产品成为真正的现金牛。
2012年,爵士制药与特种制药公司Azur Pharma完成合并,并在爱尔兰都柏林设立新的总部。此次收购为公司带来了多种CNS和女性健康领域产品。同一年,公司以6.5亿美元收购EUSA Pharma,引入了肿瘤学产品Erwinaze/Erwinase,并在欧洲建立了商业设施。2012年9月,公司以9500万美元将其女性健康业务出售给瑞典Meda公司。2014年,爵士制药以10亿美元收购罕见病药物开发商Gentium,获其肝小静脉闭塞症产品Defitelio。2016年,该公司以15亿美元收购Celator Pharmaceuticals,获得了Vyxeos治疗急性髓性白血病的权利。2019年,公司以3.125亿美元收购Cavion,获其特发性震颤候选产品。2021年,公司收购大麻素药物领军企业GW Pharmaceuticals。目前,爵士制药已成为一家深耕于神经科学和肿瘤领域的特种药物开发企业,截至2022年6月14日收盘,其市值约89.33亿美元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
FDA/EMA;
NMPA/CDE;
药融云数据库 https://www.pharnexcloud.com/?zmt-mhwz;
爵士制药相关公司公开披露;
https://www.jazzpharma.com/;
https://www.jazzpharma.com/wp-content/uploads/2016/01/Company_Profile_Deb13Nov.pdf;
DauvilliersY Arnulf I, Foldvary-Schaefer N, et al. Efficacy and safety oflower-sodium oxybate in adults with idiopathic hypersomnia: a phase3, placebo-controlled, double-blind, randomized withdrawal study.Lancet Neurology. 2022;21(1):53-65.doi:10.1016/S1474-4422(21)00368-9;
https://mp.weixin.qq.com/s/wF7Rn6rHdwmt41Vj8vmfwA;
https://mp.weixin.qq.com/s/1RAqCgrd_7JIxpqQkgZLrA;等等。
想要解锁更多药企产品管线信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论