背景介绍
根据《化学药物(原料药和制剂)稳定性研究技术指导原则(修订)》和ICH Q1A(R2)《 Stability testing ofNew Drug Substances and Products 》;将稳定性部分要点整理如下:

1、稳定性试验放置条件
NMPA和ICH的稳定性指南均是针对上市申请;NMPA和FDA均无针对IND申请的稳定性指南。下文针对IND的具体要求,是基于项目申报的经验进行整理。

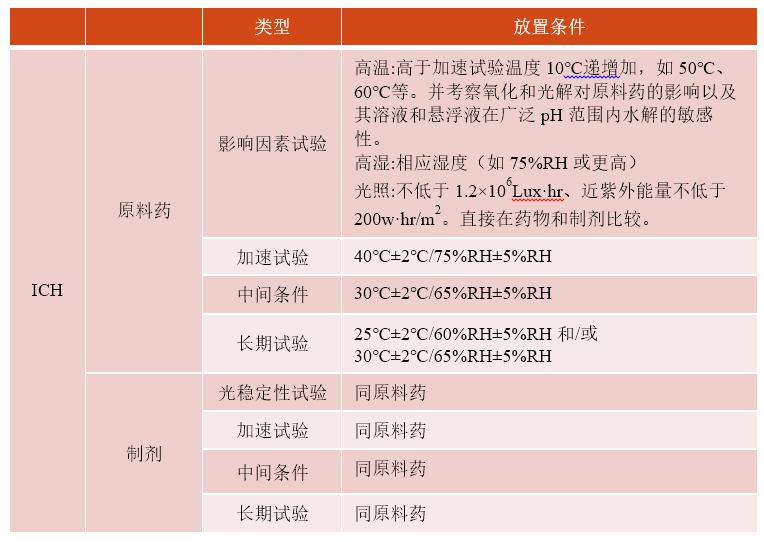
建议:原料药与制剂采用相同的放置条件进行考察。
2、取样时间点选择


3、IND和NDA需提交几个月的稳定性数据

4、稳定性试验的检测项目
中国:
原料药的考察项目通常包括:性状(外观、熔点或凝点、旋光度或比旋度等)、酸碱度、溶液的颜色与澄清度、杂质(异构体、降解产物等)、晶型、粒度、干燥失重/水分、含量等。(另外,还应根据品种的具体情况,有针对性的设置考察项目;如聚合物的黏度、分子量及分子量分布等;无菌原料药的细菌内毒素/热原、无菌、可见异物等)
制剂的考察项目通常包括:性状(外观)、杂质(降解产物等)、水分和含量等。(另外,还应根据剂型的特点设置能够反映其质量特性的指标;如固体口服制剂的溶出度,缓控释制剂、肠溶制剂、透皮贴剂的释放度,吸入制剂的粒度与粒度分布,脂质体的包封率及泄漏率等).
稳定性研究应考察在贮藏过程中易发生变化的,可能影响制剂质量、安全性和/或有效性的项目;内容应涵盖物理、化学、生物学、微生物学特性,以及防腐剂的含量(如,抗氧剂、抑菌剂)和制剂功能性测试(如,定量给药系统)等.
ICH:
原料药:包括那些在贮存时易变化,且有可能影响质量、安全性和(或)有效性的内容。稳定性资料应当包括物理、化学和微生物试验方面的内容.
制剂:应该包括在贮存期内易于改变和可能影响质量、安全性和(或)药效的那些因素. 不仅应包括化学和生物学稳定性,而且还应包括防腐剂的损失、物理性能和特性、外观以及必要的微生物特性。应该对在试验放置样品的防腐有效性进行试验和检测,以确定抗微生物防腐剂的含量和效果。
5、稳定性考察所需的批次

6、什么条件下进行中间条件试验

建议原料药采用与制剂相同的放置条件,将易于作比较和评价。如果在40±2℃/75%RH±5%的加速试验条件下放置6 个月后发生“明显变化”,则应在中间试验条件(如30±2℃/60%RH±5%)下作附加试验,这些资料均包括在注册申请中。
显著性变化的具体内容

7、稳定性试验样品包装要求(IND)

8、稳定性样品制备条件

9、多规格制剂如何放稳定性

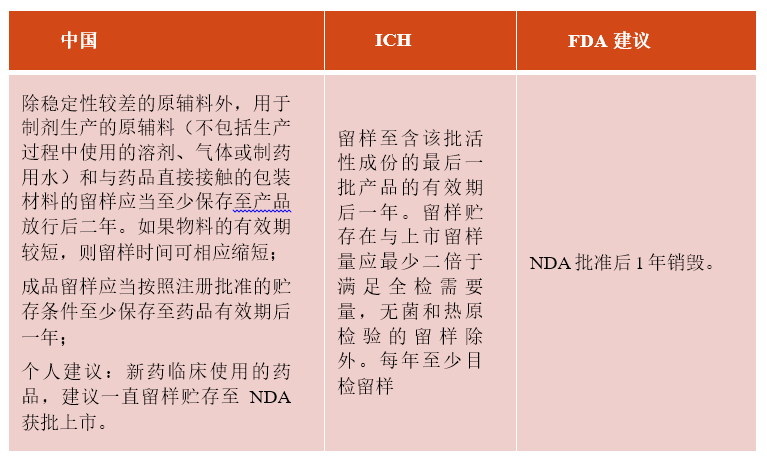
10、获得批准后稳定性样品多久后销毁

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论