2021年美国临床肿瘤学会(ASCO)年会于6月4日至6月8日在美国举行,我国多家药企携新药进展亮相ASCO。
ASCO年会是世界上规模最大、学术水平最高、最具有权威性的临床肿瘤学会议,汇聚了来自世界各地的一流肿瘤学专家,很多重要的研究发现及最新的临床试验成果也会在此进行首次发布。
今年共有5项重磅研究摘要(Late Breaking Abstract,LBA)入围,涉及乳腺癌、鼻咽癌、宫颈癌、前列腺癌和肾癌等五大癌种。
一、亚盛医药四项研究成果入选
亚盛医药已连续四年亮相ASCO,今年亚盛医药在ASCO年会上展示了3个在研创新药的四项临床研究。
图1:亚盛医药四项研究成果入选

图片来源:ASCO年会壁报
1. 新型BCL2抑制剂APG-2575治疗慢性淋巴细胞白血病的首次人体试验
选择性BCL2(B细胞淋巴瘤和白血病蛋白2)抑制剂lisaftoclax片剂(APG-2575),曾获孤儿药资格认定,能诱导细胞凋亡,抑制细胞生长。APG-2575初步显示出对慢性淋巴细胞白血病患者良好的安全性和极具潜力的抗肿瘤活性,并对其他几种血液系统恶性肿瘤(急性骨髓性白血病、幼淋巴细胞白血病等)也有潜在的疾病控制作用。慢性淋巴细胞白血病患者中的总缓解率高达80%;安全性方面,在最高剂量1200mg仍未观察到剂量限制毒性。
这项首次在人体进行的全球I期临床研究评估了APG-2575在慢性淋巴细胞白血病患者中的安全性、药代动力学、药效动力学、疗效和最大耐受量/II期研究推荐剂量。
APG-2575耐受性良好,不良事件可控,未达到最大耐受量,无临床或实验室肿瘤溶解综合征报告。在被观察到的任何级别治疗相关不良事件(TRAEs)中,发生率大于10%的血液学TRAEs包括中性粒细胞减少和贫血,非血液学TRAEs包括疲乏、腹泻、便秘和恶心。
2. APG-115联合帕博利珠单抗治疗黑色素瘤的Ⅱ期临床研究结果
MDM2(Mdm2 p53结合蛋白)抑制剂APG-115胶囊剂,曾获孤儿药资格认定。
该试验评估APG-115联合帕博利珠单抗在晚期实体瘤患者中的安全性、耐受性、药代动力学、药效动力学和抗肿瘤活性。APG-115根据RP2D剂量150mg隔日口服一次,并与帕博利珠单抗联用。
在被观察到的任何级别治疗相关不良事件(TRAEs)中,发生率大于10%的TRAEs有恶心、血小板减少、呕吐、疲乏、食欲下降、腹泻、中性粒细胞减少和贫血。
APG-115联合帕博利珠单抗的耐受性良好,且无叠加毒性。初步研究结果为APG-115联合帕博利珠单抗治疗经肿瘤免疫疗法后复发/难治性转移性黑色素瘤提供了临床依据。同时,该联合治疗在帕博利珠单抗无获批适应症的恶性周围神经鞘瘤和脂肪肉瘤患者中也具有良好的抗肿瘤活性。
二、百泽安两项临床试验入选
2021ASCO年会上,百济神州公布其PD-1抑制剂百泽安(tislelizumab、替雷利珠单抗)对比化疗用于既往经治的晚期或转移性食管鳞状细胞癌的3期试验,和用于既往经治、局部晚期不可切除或转移性高度微卫星不稳定型或错配修复缺陷型实体瘤的关键性2期试验。
替雷利珠单抗注射液是一款人源化程序性细胞死亡蛋白1单克隆抗体,能最大限度地减少与巨噬细胞中的Fcγ受体结合,2019年12月26日在我国上市,现纳入医保乙类,用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤以及PD-L1高表达的含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌。NMPA已批准百泽安的三个适应症:晚期鳞状非小细胞肺癌、复发或难治性经典型霍奇金淋巴瘤以及局部晚期或转移性尿路上皮癌。
1. 百泽安对比化疗用于既往经治的晚期或转移性食管鳞状细胞癌
百泽安对比化疗用于既往经治的晚期或转移性食管鳞状细胞癌的试验是一项随机、开放性、多中心的全球3期临床试验,旨在评估百泽安对比研究者选择的化疗作为晚期或转移性食管鳞状细胞癌患者二线治疗的有效性和安全性。
研究结果表明,百泽安显著延长了晚期或转移性食管鳞状细胞癌患者的生存期,在预定义的亚组(包括PD-L1表达和患者人种)中观察到趋势一致的生存获益。百泽安的安全性也较有优势,未出现新的安全性警示。


图片来源:药融云整理制图
2. 百泽安用于既往经治、局部晚期不可切除或转移性实体瘤
本项单臂、开放性、多中心的关键性2期试验旨在评价百泽安单药治疗既往经治、局部晚期不可切除或转移性实体瘤患者的有效性和安全性,入组了80例中国患者。
百泽安显示出具有统计学显著性和持久的抗肿瘤活性,各肿瘤类型的有效性结果呈现出一致的趋势,证明了泛瘤种治疗的获益。百泽安的总体耐受性良好,未发现新的安全性信号。安全性结果与疾病的预期表现和其他抗PD-1抗体的已知作用一致。
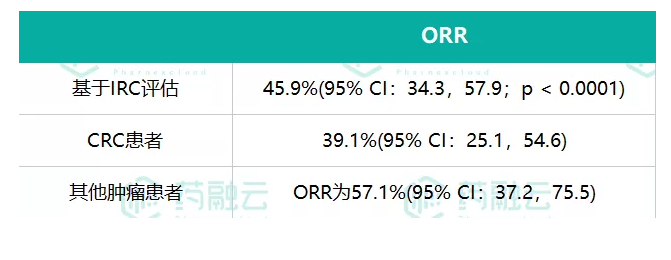
图片来源:药融云整理制图
三、特瑞普利单抗39项研究亮相
在2021ASCO年会上,特瑞普利单抗共有39项相关研究集中亮相,包括一项全体大会口头报告、一项专场口头报告、15项壁报展示和若干线上摘要,覆盖鼻咽癌、头颈癌、黑色素瘤、肺癌、胃癌、食管癌、肝癌、胆管癌、胰腺癌等10多个瘤种。
特瑞普利单抗(toripalimab)注射液是我国首个批准上市的国产PD-1单抗,目前NMPA已批准其用于治疗复发/转移性鼻咽癌、转移性尿路上皮癌、IV期黑色素瘤。曾获突破性疗法、快速通道、孤儿药、优先审评资格认定。
JUPITER-02研究是一项国际多中心、双盲、安慰剂对照的III期临床试验,旨在评估特瑞普利单抗联合GP(吉西他滨和顺铂)化疗一线治疗复发/转移性鼻咽癌患者的疗效性和安全性。

图片来源:药融云整理制图
与安慰剂组相比,特瑞普利单抗组的PFS显著改善。特瑞普利单抗联合治疗组有总生存的获益趋势,其死亡风险降低了40%。两组的3级及以上不良事件发生率相似(89.0%vs.89.5%),特瑞普利单抗组未观察到新的安全性信号。
与单纯化疗相比,特瑞普利单抗联合GP化疗一线治疗复发/转移性鼻咽癌可获得更优的PFS、更高的ORR和更长的DOR,且具有良好的安全性和耐受性,有望成为复发/转移性鼻咽癌一线治疗的新标准。
结语
一年一度的ASCO年会是创新药行业催化剂最为密集的时期,全世界的肿瘤创新药企往往在会上发布最新的临床试验进展,中国创新药企大面积登上ASCO舞台,表明国内的创新药技术发展已经从早期的me-too类跟进式创新逐步向me-better或者First-in-Class级别的创新实现跃迁,逐步跻身国际一流创新药企业的竞争行列。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论