肿瘤一直是人类健康的重大威胁,目前的一线治疗方案,比如外科手术、放疗、化疗,对于中晚期恶性肿瘤效果都有限。免疫疗法作为一种新出现的治疗方案,在多种癌症中都取得了很好的效果。其中特别受关注的是免疫检查点抑制剂,其作用机理是通过重新激活被肿瘤诱导抑制的T细胞,基于人体自身的免疫系统来打击肿瘤细胞。但是,有关数据表明当患者缺乏自发性T细胞应答时,免疫检查点抑制剂的疗效就比较差。
近年来发现的干扰素基因刺激蛋白(Stimulator of interferon genes,STING),是一种能够调节固有免疫功能的重要靶标分子。STING 的胞质部分以二聚体形式存在。全长 STING 的结构直到 2019 年, 才由 Shang 等利用冷冻电镜技术解析完全。
STING(human STING, hSTING)的结构如图1,包含一个跨膜的 N 末端结构域和一个球状的 C 末端结构域(C-terminal domain, CTD)。
N 末端结构域分为 4 个跨膜的区域(transmembrane region1~4, TM1~4),主要负责将 STING 锚定于内质网膜或其他细胞器膜上。在 STING 二聚体中,TM1~4 采用结构域交换结构,其中一个亚基的TM1与另一个亚基的TM2、TM3和TM4 组合在一起,8个跨膜区组成两层:两个亚基的 TM2和 TM4形成了中央层,被外围的TM1和TM3包围。
CTD暴露在细胞质中,包含配体与蛋白结合的区域(ligand-binding domain, LBD)和 C尾端结构域 (C-terminal tail, CTT)。LBD包括 4 个 α 螺旋(LBDα1~α4)和 5 个 β 折叠片层 (LBDβ1~β5)。连接 TM4 和 LBDα1 的连接子包括一个连接螺旋和一个连接环, 在二聚体中两个连接子形成右旋交叉,使同一 STING 分子的 TM 和 LBD 分布在二聚体的对侧。
TM2 和 TM3 之间的连接桥、连接螺旋和 LBD 共同形成胞质和 跨膜结构域之间的表面沟槽,TM1 之前的 N 末端段位于这个沟槽中,这种域间 相互作用是一种保守的结构特征,对蛋白质的稳定性和功能非常重要。CTT 与 STING 的胞质部分结合,包含结合 TANK 结合激酶 1(TANK binding kinase 1, TBK1)的基序(TBK1-binding motif, TBM)和结合干扰素调节因子 3(interferon regulatory factor 3, IRF3)的基序。
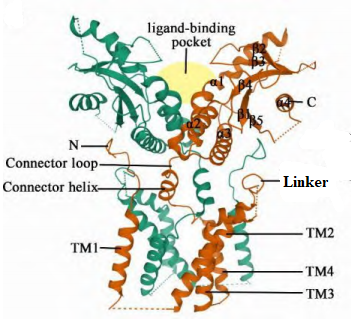
图1 STING 的结构
干扰素基因刺激蛋白是固定在内质网上感知外源DNA入侵的重要衔接蛋白,通过靶向STING激活cGAS-STING信号通路诱导抗肿瘤天然免疫,无疑已成为继PD-1/PD-L1等免疫检查点抑制剂之后的免疫治疗的一匹“黑马”。STING与其配体cGAMP的结合可促进STING二聚或寡聚,进而集结丝氨酸/苏氨酸蛋白激酶(TBK1),磷酸化干扰素调节转录因子IRF3,诱导I型干扰素(IFN)及诸多促炎细胞因子的产生,最终激活细胞毒CD8 T细胞来促进适应性免疫应答。(作用机制如图2)
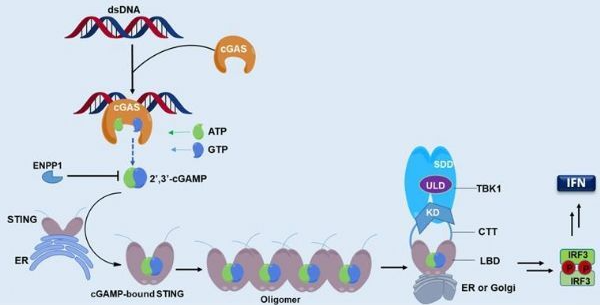
图2
目前,STING激动剂类抗肿瘤药物开发取得了较大的进展,多个药物已经进入临床研究。(如图3,部分在研究中STING激动剂)包括ImmuneSensor Therapeutics公司旗下的IMSA-101,葛兰素史克旗下的GSK3745417,百时美施贵宝公司旗下的BMS-986301,Spring Bank Pharmaceuticals公司旗下的SB-11285,默沙东公司旗下的MK-1454。

图3 部分在研究中STING激动剂
2021年4月8日,成都先导药物开发股份有限公司(以下简称“成都先导”)开发出首个在中国自主研发获批开展临床研究的STING激动剂—HG381。注射用HG381为化药注册一类新药,临床拟用于治疗晚期实体瘤。

图片来自国家药品监督管理局临床试验批件
目前,HG381是首个在中国获批开展临床试验的STING激动剂,同时是全球公开报道的第四个进入临床的第二代STING激动剂。据报道,HG381前期的临床前药效试验显示,在结肠癌、肝癌、乳腺癌、肺癌等多种小鼠肿瘤模型中,1周1次给予HG381可显著抑制肿瘤生长并引起肿瘤消退。HG381同时能够诱导机体产生抗肿瘤免疫记忆,抑制肿瘤的重新生长。同时,HG381与PD-1抗体或靶向药物联用展现出更加优异的药效。小鼠和猴的毒理学研究证实HG381有较好的安全性和较宽的治疗窗。作为第二代STING激动剂,HG381有望克服PD-1抗体等免疫检查点抑制剂耐药的难题。
参考文献:
Ouyang S, Song X, Wang Y, et al. Structural analysis of the STING adaptor protein reveals a hydrophobic dimer interface and mode of cyclic di-GMP binding [J]. Immunity, 2012, 36: 1073-1086
Chin KH, Tu ZL, Su YC, et al. Novel c-di-GMP recognition modes of the mouse innate immune adaptor protein STING [J]. Acta Crystallogr, Sect D: Struct Biol, 2013, 69: 352-366.
Shang G, Zhang C, Chen ZJ, et al. Cryo-EM structures of STING reveal its mechanism of activation by cyclic GMP-AMP [J]. Nature, 2019, 567: 389-393.
Zhang C, Shang G, Gui X, et al. Structural basis of STING binding with and phosphorylation by TBK1 [J]. Nature, 2019, 567: 394-398.
Ergun SL, Fernandez D, Weiss TM, et al. STING polymer structure reveals mechanisms for activation, hyperactivation, and inhibition [J]. Cell, 2019, 178: 290-301.
本文为原创稿件,未经授权请勿转载。









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论