1.5.1 本周全球TOP10创新药研发进展
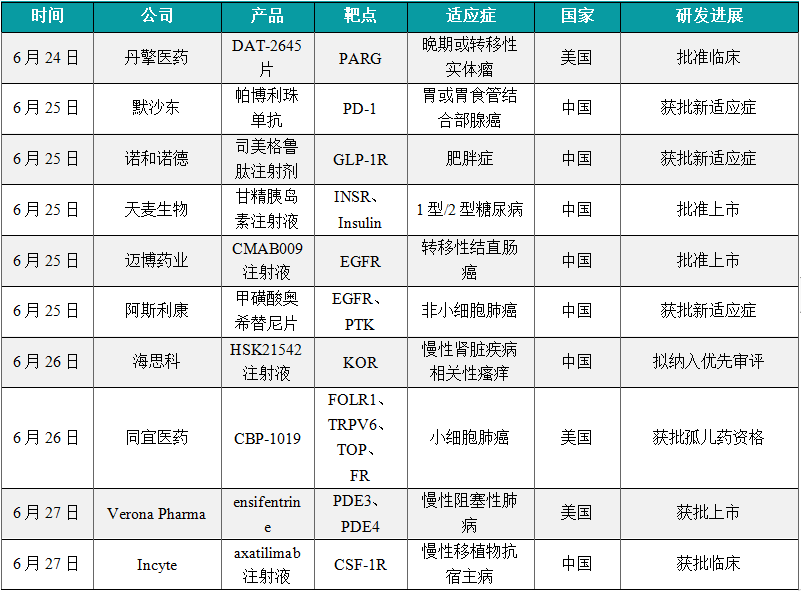
(1)丹擎医药PARG抑制剂在美国获批临床
6月24日,丹擎医药宣布,该公司的PARG抑制剂DAT-2645片的新药临床试验申请已经于近日获得美国FDA批准。丹擎医药将在中国和美国开展多中心,开放标签、剂量递增和剂量扩展的1期临床试验,于2024年下半年启动临床试验患者入组,用于评估DAT-2645单药治疗携带BRCA1/2功能缺失性突变和/或同源重组缺陷(HRD)的晚期或转移性实体瘤患者的安全性和有效性。DAT-2645通过合成致死的机制特异性地杀伤携带特定DNA损伤修复缺陷的肿瘤细胞,其适应症包括乳腺癌、卵巢癌、胰腺癌、前列腺癌、子宫癌、胃癌、结直肠癌等多种常见癌症,并且有望拓展PARP抑制剂无效的适应症和解决PARP抑制剂耐药的痛点,具有潜在的“广谱治疗性”的临床应用前景。迄今为止,全球尚无PARG抑制剂获批上市。
(2)默沙东帕博利珠单抗在华获批新适应症,治疗胃癌
6月25日,默沙东(MSD)的抗PD-1单抗帕博利珠单抗又一项新适应症上市申请获得批准。根据默沙东新闻稿,该药本次获批的适应症为:联合曲妥珠单抗、含氟尿嘧啶类和铂类药物化疗,用于经充分验证的检测评估肿瘤表达PD-L1(CPS≥1)的局部晚期不可切除或转移性HER2阳性胃或胃食管结合部腺癌患者的一线治疗。至此,帕博利珠单抗在中国获批的适应证已经达到14个。
(3)诺和诺德的司美格鲁肽在中国再获批,用于长期体重管理
6月25日,诺和诺德(Novo Nordisk)宣布,该公司每周注射一次的司美格鲁肽2.4mg注射剂(商品名:Wegovy)在中国获批,针对适应症为长期体重管理。司美格鲁肽是一种长效GLP-1类似物,它与天然GLP-1的氨基酸序列具有94%的同源性,能起到GLP-1受体激动剂的作用。该产品通过降低饥饿感,增加饱腹感,从而帮助患者减少饮食并降低其热量摄入,以达到减重的目的。该药物的减重适应症于2021年获美国FDA批准,用于成年肥胖症或超重并伴有至少一种体重相关合并症的患者结合饮食和运动进行长期体重管理。这也是FDA自2014年以来批准的首款用于控制普通肥胖症或超重的新药。本次该产品在中国获批减重适应症,标志着这款突破性药物即将惠及中国广大超重和肥胖症患者。
(4)天麦生物的甘精胰岛素生物类似药获批上市,用于长效平稳控制血糖
6月25日,天麦生物甘精胰岛素注射液生物类似药上市申请获得批准。公开资料显示,甘精胰岛素是一种长效人胰岛素类似物 ,用于治疗1型和2型糖尿病 ,能够更长效、平稳地控制患者的血糖。甘精胰岛素是通过DNA重组技术生产的长效胰岛素类似物,属于第三代胰岛素。在药效上,甘精胰岛素皮下注射后能持续缓慢释放胰岛素单体,相较于传统人胰岛素药物,其降糖作用可持续约24h,且几乎无峰值,可以更好的模拟正常基础人胰岛素的分泌,临床上可以与餐时胰岛素或者口服降糖药联合使用。
(5)迈博药业EGFR单抗CMAB009注射液在中国获批上市,用于治疗结直肠癌
6月25日,迈博药业研发的CMAB009注射液的上市申请被正式批准。CMAB009是一种重组抗表皮生长因子受体(EGFR)嵌合单克隆抗体,为基于西妥昔单抗研发的改良型生物制品,本次获批与FOLFIRI(亚叶酸、5FU和伊立替康)联合用于转移性结直肠癌(mCRC)的一线治疗。据迈博药业公开资料介绍, CMAB009采用特定表达工艺制备,有效避免了导致超敏反应的糖基化修饰。该产品的安全性及疗效由两项已完成临床试验的结果所证实。临床试验结果显示,该药物的疗效显著,并且能显著降低免疫原性,减少严重超敏反应等不良反应的发生。声再明董事长唐任宏博士曾在新闻稿中表示,CMAB009是一款具有临床差异化优势的抗肿瘤产品,能够惠及结直肠癌等多个瘤种的患者群体。根据迈博药业早前发布的公告,CMAB009未来预计适应症有望拓展到头颈部鳞癌等癌种。
(6)阿斯利康重磅肺癌药物奥希替尼新适应症在中国获批
6月25日,阿斯利康申报的甲磺酸奥希替尼片新适应症上市申请已获得批准。奥希替尼(osimertinib)是由阿斯利康开发的一种不可逆的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。据悉,该药本次获批的新适应症为联合化疗一线治疗EGFR突变晚期非小细胞肺癌(NSCLC)。奥希替尼是阿斯利康旗下的重磅肺癌治疗药物,其在非小细胞肺癌患者中已表现出确证的临床疗效。目前,奥希替尼已在美国、欧盟、中国和日本等100多个国家和地区获批作为单一疗法使用,批准的适应症包括局部晚期或转移性EGFRm非小细胞肺癌患者的一线治疗,局部晚期或转移性EGFR T790M突变阳性非小细胞肺癌患者的二线治疗,以及早期EGFRm非小细胞肺癌的辅助治疗。此外,该药还已在美国和其他一些国家获批联合化疗用于局部晚期或转移性EGFRm非小细胞肺癌患者的一线治疗。
(7)海思科1类新药HSK21542注射液拟纳入优先审评,治疗相关瘙痒症
6月26日,中国国家药监局药品审评中心官网公示,海思科申报的HSK21542注射液拟纳入优先审评,针对适应症为治疗慢性肾脏疾病相关性瘙痒。根据海思科公开资料,HSK21542是其研发的强效外周kappa阿片受体(KOR)选择性激动剂,该产品的腹部手术术后镇痛的上市申请此前已经获得CDE受理。HSK21542正是海思科研发的外周选择性KOR激动剂,目前开发的制剂为注射液和口服片剂,主要用于瘙痒和疼痛的治疗。该产品通过抑制背根神经节和外周末梢感觉神经的兴奋性,减少炎性因子以及神经递质的释放,起到镇痛和抑制瘙痒的作用。根据海思科此前新闻稿介绍,根据非临床研究,其具有高选择性和高亲和性,缓解瘙痒效果确切,兼具良好的安全性和耐受性。
(8)同宜医药的CBP-1019再获FDA授予孤儿药资格,治疗小细胞肺癌
6月26日,同宜医药宣布美国FDA已授予其自主研发的第二代双配体偶联药物(Bi-XDC)CBP-1019用于治疗小细胞肺癌(SCLC)的孤儿药资格。截至目前,CBP-1019已获得FDA授予3个孤儿药资格,分别用于治疗胰腺癌、食管癌和小细胞肺癌。CBP-1019是同宜医药开发的第二代Bi-XDC技术产品,药物设计采用双配体FRα/TRPV6搭载新一代载药喜树碱衍生物,在Bi-XDC药物CBP-1008的基础上进一步进行了创新和优化。根据临床前研究数据,在妇科肿瘤、肺癌、胰腺癌、结直肠癌等多种肿瘤中,CBP-1019都表现出抑制肿瘤的效果。
(9)Verona的ensifentrine获FDA批准,作为维持疗法治疗慢性阻塞性肺病成人患者
6月27日,Verona Pharma公司宣布,美国FDA批准其“first-in-class”磷酸二酯酶3/4(PDE3/4)抑制剂Ohtuvayre(ensifentrine)作为维持疗法治疗慢性阻塞性肺病(COPD)成人患者。新闻稿指出,这是具有支气管扩张和非类固醇抗炎作用的首个吸入式COPD疗法。此外,ensifentrine也是20多年来具有新作用机制、用于COPD维持治疗的首个吸入式疗法。该疗法也在今年初被行业媒体Evaluate列为2024有望获批的10款重磅疗法之一。Ensifentrine是一款“first-in-class”的PDE3/4抑制剂,双重抑制机理使其能够凭借单个化合物同时实现支气管扩张和抗炎效果。2021年6月,Verona公司授予优锐医药在大中华区临床开发和商业化ensifentrine的独家权利。
(10)Incyte的axatilimab注射液获批临床,治疗慢性移植物抗宿主病
6月27日,Incyte公司申报的1类新药axatilimab注射液获批临床,拟用于治疗既往接受过系统治疗后复发或难治活动性慢性移植物抗宿主病(cGVHD)。公开资料显示,这是一款抗集落刺激因子-1受体(CSF-1R)抗体,该产品治疗cGVHD的上市申请已经获美国FDA授予优先审评资格。Axatilimab是一款靶向CSF-1R的在研单克隆抗体。CSF-1R是一种细胞表面蛋白,被认为控制单核细胞和巨噬细胞的存活和功能。在临床前模型中,通过CSF-1受体抑制信号传导已被证明可减少疾病介导的巨噬细胞及其单核细胞前体的数量,这已被证明在cGVHD和特发性肺纤维化(IPF)等疾病的纤维化疾病过程中发挥关键作用。
1.5.2 本周全球TOP10积极/失败临床结果
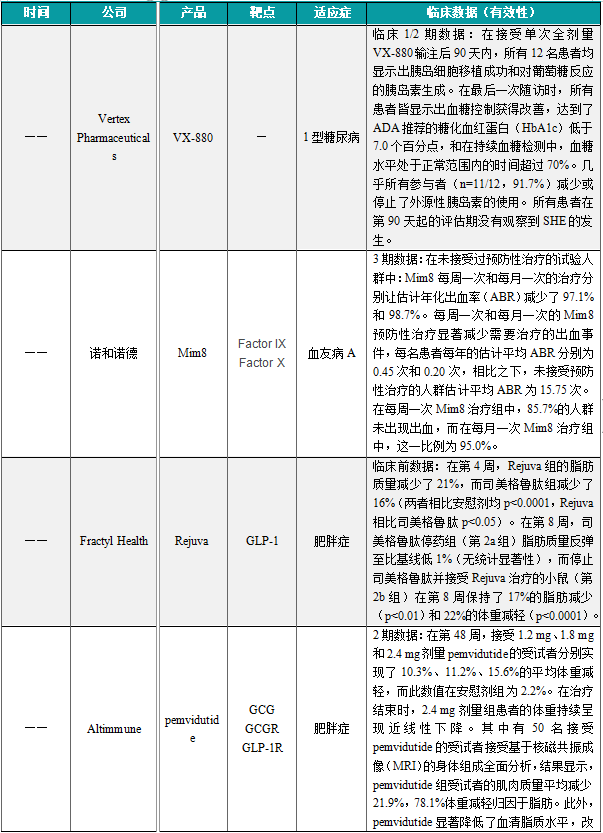
(1)Vertex Pharmaceuticals公布VX-880临床1/2期试验的最新数据,疗效持续逾1年
近日,Vertex Pharmaceuticals公布其在研细胞疗法VX-880于临床1/2期试验的最新数据。分析显示,在接受单次全剂量VX-880输注后90天内,在接受单次全剂量VX-880输注后90天内,所有12名患者均显示出胰岛细胞移植成功和对葡萄糖反应的胰岛素生成。在最后一次随访时,所有患者皆显示出血糖控制获得改善,达到了ADA推荐的糖化血红蛋白(HbA1c)低于7.0个百分点,和在持续血糖检测中,血糖水平处于正常范围内的时间超过70%。几乎所有参与者(n=11/12,91.7%)减少或停止了外源性胰岛素的使用。所有患者在第90天起的评估期没有观察到SHE的发生。Vertex预计增加入组患者数量,并将该疗法推进关键试验阶段。
(2)诺和诺德双特异性抗体Mim8疗法3期临床结果积极,让高达95%患者无出血
近日,诺和诺德宣布了在研血友病A双特异性抗体疗法Mim8的3期临床试验FRONTIER2的最新结果。试验结果显示,在未接受过预防性治疗的试验人群中:Mim8每周一次和每月一次的治疗分别让估计年化出血率(ABR)减少了97.1%和98.7%。每周一次和每月一次的Mim8预防性治疗显著减少需要治疗的出血事件,每名患者每年的估计平均ABR分别为0.45次和0.20次,相比之下,未接受预防性治疗的人群估计平均ABR为15.75次。在每周一次Mim8治疗组中,85.7%的人群未出现出血,而在每月一次Mim8治疗组中,这一比例为95.0%。Mim8是一种模拟凝血因子VIIIa的双特异性抗体,通过皮下注射给药,它通过连接凝血因子IXa和X,替代缺失的因子VIII,有效恢复身体的凝血酶生成能力,帮助血液凝固。
(3)Fractyl Healt公布基因疗法Rejuva的最新临床前数据,减重效果良好。
近日,Fractyl Health公司展示了其在研胰腺GLP-1基因疗法Rejuva的最新临床前数据。实验数据显示,在第4周,Rejuva组的脂肪质量减少了21%,而司美格鲁肽组减少了16%(两者相比安慰剂均p<0.0001,Rejuva相比司美格鲁肽p<0.05)。第8周,司美格鲁肽停药组(第2a组)脂肪质量反弹至比基线低1%(无统计显著性),而停止司美格鲁肽并接受Rejuva治疗的小鼠(第2b组)在第8周保持了17%的脂肪减少(p<0.01)和22%的体重减轻(p<0.0001)。Rejuva是该公司的基于腺相关病毒(AAV)的胰腺GLP-1基因疗法(PGTx),旨在通过胰腺内持久生产GLP-1来治疗肥胖和2型糖尿病(T2D),Rejuvat同时预防在司美格鲁肽停药后的血糖和体重反弹。
(4)Altimmune公布pemvidutide临床2期数据,体重减轻78.1%归因于脂肪
近日,Altimmune公司公布其在研胰高血糖素样肽-1(GLP-1)/胰高血糖素(glucagon)双受体激动剂pemvidutide用于治疗肥胖症的MOMENTUM临床2期试验数据。在第48周,接受1.2 mg、1.8 mg和2.4 mg剂量pemvidutide的受试者分别实现了10.3%、11.2%、15.6%的平均体重减轻,而此数值在安慰剂组为2.2%。在治疗结束时,2.4 mg剂量组患者的体重持续呈现近线性下降。其中有50名接受pemvidutide的受试者接受基于核磁共振成像(MRI)的身体组成全面分析,结果显示,pemvidutide组受试者的肌肉质量平均减少21.9%,78.1%体重减轻归因于脂肪。此外,pemvidutide显著降低了血清脂质水平,改善了血压,且未出现心脏事件、心律失常或临床意义上的心率增加。Pemvidutide是一种新型、在研、GLP-1/胰高血糖素双受体激动剂,正在开发用于治疗肥胖和代谢功能障碍相关脂肪性肝炎(MASH)。
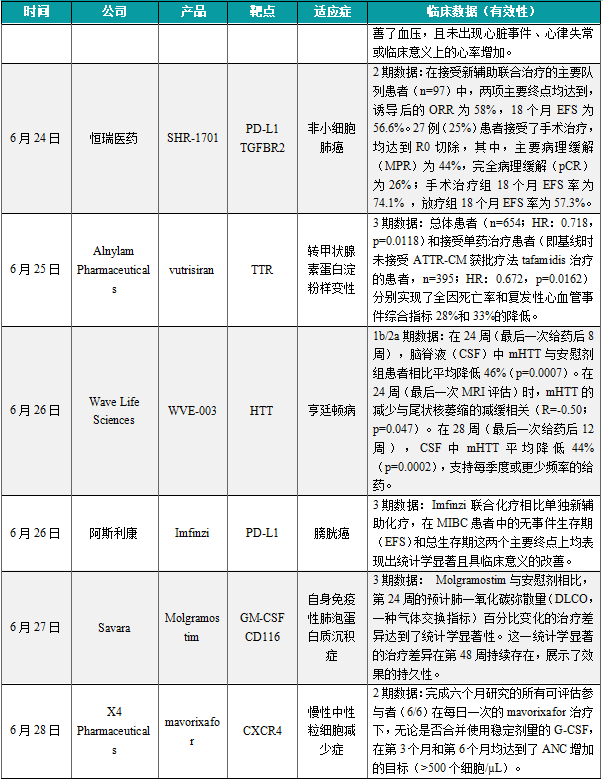
(5)恒瑞医药的SHR-1701 2期研究结果公开,治疗非小细胞肺癌效果积极
6月24日,恒瑞医药宣布,其自主研发的PD-L1/TGF-βRII双抗SHR-1701联合或不联合化疗新辅助治疗不可切除的Ⅲ期非小细胞肺癌的概念验证2期临床研究(TRAILBLAZE研究)成果,正式全文在线发表于国际权威学术期刊Cancer Cell。研究结果显示,在接受新辅助联合治疗的主要队列患者(n=97)中,两项主要终点均达到,诱导后的ORR为58%,18个月EFS为56.6%。27例(25%)患者接受了手术治疗,均达到R0切除,其中,主要病理缓解(MPR)为44%,完全病理缓解(pCR)为26%;手术治疗组18个月EFS率为74.1% ,放疗组18个月EFS率为57.3%。研究人员认为,在不可切除的Ⅲ期非小细胞肺癌患者中,新辅助SHR-1701联合化疗(随后进行手术或放疗)显示出具有前景的疗效和可耐受的安全性。在相当比例的患者(1/4)中,手术转化是可行的,并且与较好的生存结局相关。
(6)Alnylam皮下注射RNAi疗法vutrisiran 3期结果积极,治疗转甲状腺素蛋白介导的淀粉样变性
6月25日,Alnylam Pharmaceuticals公布其HELIOS-B临床3期研究的积极顶线结果,其皮下注射RNAi疗法Amvuttra(vutrisiran)作为单药,可降低伴有心肌病的转甲状腺素蛋白介导的淀粉样变性(ATTR-CM)患者因任何原因死亡或发生复发性心血管事件的风险。分析显示在双盲期间,总体患者(n=654;HR:0.718,p=0.0118)和接受单药治疗患者(即基线时未接受ATTR-CM获批疗法tafamidis治疗的患者,n=395;HR:0.672,p=0.0162)分别实现了全因死亡率和复发性心血管事件综合指标28%和33%的降低。在所有关键亚组患者中,vutrisiran在主要终点和所有次要终点均表现出一致的效果,包括基线tafamidis使用情况、ATTR疾病类型和疾病严重程度。
(7)Wave Life Sciences公布WVE-003的 1b/2a期试验结果,在治疗亨廷顿病中取得了积极成果
6月26日,Wave Life Sciences宣布在研疗法WVE-003在治疗亨廷顿病(HD)的1b/2a期临床试验SELECT-HD中取得了积极成果。实验结果显示,在24周(最后一次给药后8周),脑脊液(CSF)中mHTT与安慰剂组患者相比平均降低46%(p=0.0007)。在24周(最后一次MRI评估)时,mHTT的减少与尾状核萎缩的减缓相关(R=-0.50;p=0.047)。在28周(最后一次给药后12周),CSF中mHTT平均降低44%(p=0.0002),支持每季度或更少频率的给药。WVE-003是一款等位基因选择性反义寡核苷酸(ASO),旨在降低突变亨廷顿蛋白(mHTT)表达并保留健康的野生型亨廷顿蛋白(wtHTT)。
(8)阿斯利康重磅疗法Imfinzi3期结果公布,显著延长患者总生存期
6月26日,阿斯利康公司公布了3期临床试验NIAGARA的积极结果。分析显示,与单独新辅助化疗相比,其重磅免疫疗法Imfinzi与化疗联用,在MIBC患者中的无事件生存期(EFS)和总生存期这两个主要终点上均表现出统计学显著且具临床意义的改善。根据新闻稿,这是可在手术前并在手术后使用可延长膀胱癌患者生存期的首个免疫治疗方案。Imfinzi是一种人源化单克隆抗体,它与PD-L1蛋白结合并阻断PD-L1与PD-1及CD80蛋白的相互作用,从而对抗肿瘤的免疫逃逸策略,并解除对免疫反应的抑制,增强免疫系统杀伤癌细胞的能力。
(9)Savara突破性疗法molgramostim达到3期临床主要终点,明年递交上市申请
6月27日,Savara公司宣布,关键性3期临床试验IMPALA-2达到主要终点。IMPALA-2是一项为期48周的随机双盲、含安慰剂对照临床试验,评估每天一次吸入300微克molgramostim或匹配安慰剂在患有自身免疫性肺泡蛋白质沉积症(aPAP)成年患者中的疗效和安全性。数据显示,该试验达到了主要终点。Molgramostim与安慰剂相比,第24周的预计肺一氧化碳弥散量(DLCO,一种气体交换指标)百分比变化的治疗差异达到了统计学显著性。这一统计学显著的治疗差异在第48周持续存在,展示了效果的持久性。Molgramostim已获得美国FDA授予的孤儿药资格、快速通道资格和突破性疗法认定,用于治疗aPAP。该公司公司计划在2025年上半年完成生物制品许可申请(BLA)的提交。
(10)X4 Pharmaceuticals公布mavorixafor2期临床结果,100%可评估患者症状改善
6月28日,X4 Pharmaceuticals宣布了其正在进行的2期临床试验的积极临床数据,该试验评估了口服CXC趋化因子受体4(CXCR4)拮抗剂mavorixafor在治疗慢性中性粒细胞减少症(CN)患者中的安全性和有效性。对6个月研究数据的中期分析显示,每日一次口服mavorixafor通常耐受性良好,并且无论是否合并使用稳定剂量的G-CSF,在第3个月和第6个月均达到了ANC增加的目标(>500个细胞/µL)。Mavorixafor是一种选择性CXCR4拮抗剂,它已经获得FDA批准用于治疗12岁及以上患有WHIM综合征的患者,以增加血液循环中成熟中性粒细胞和淋巴细胞的数量。它曾经获得FDA授予的突破性疗法认定,治疗WHIM综合征。
同期事件:
1. 2025年第26周06.24-06.30国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第26周06.24-06.30国内仿制药/生物类似物申报/审批数据分析
3. 2024年第26周06.24-06.30国内医药大健康行业政策法规汇总
4. 2024年第26周06.24-06.30全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.06.24-2024.06.30)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论