1.5.1 本周全球TOP10创新药研发进展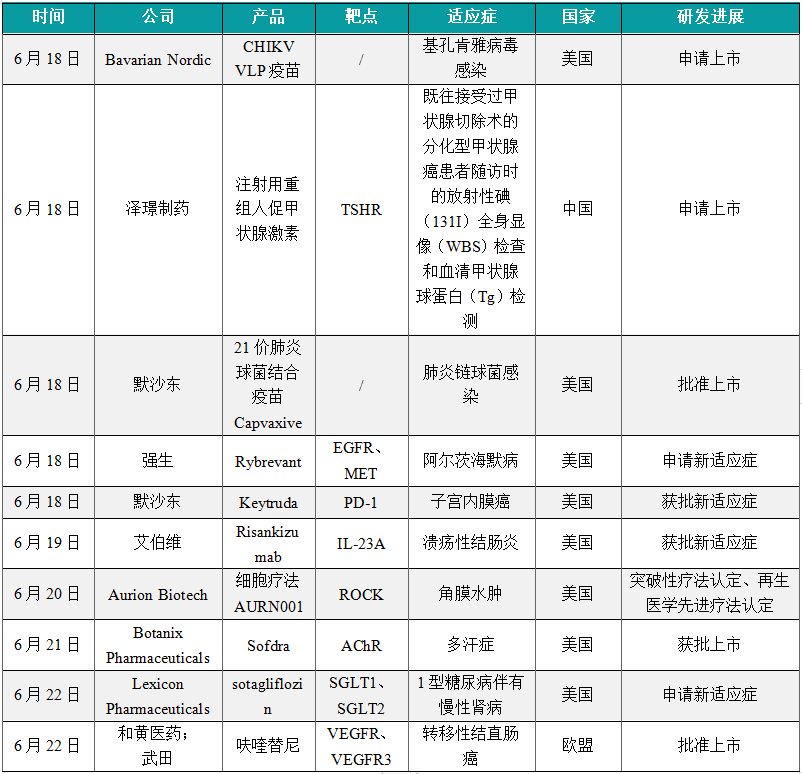 (1)Bavarian Nordic公司完成突破性病毒样颗粒疫苗生物制品许可申请提交
(1)Bavarian Nordic公司完成突破性病毒样颗粒疫苗生物制品许可申请提交
6月18日,Bavarian Nordic公司宣布,已完成向美国FDA滚动提交候选疫苗CHIKV VLP的生物制品许可申请(BLA),用于在12岁及以上人群中预防基孔肯雅病毒感染。新闻稿指出,该疫苗有望在2025年上半年获得批准。CHIKV VLP是一种基于病毒样颗粒(VLP)的在研疫苗,用于引发抗基孔肯雅病的主动免疫。CHIKV VLP已获得美国FDA的突破性疗法认定和快速通道资格,以及欧洲药品管理局(EMA)的PRIME资格。
(2)泽璟制药重组人促甲状腺激素申报上市
6月18日,泽璟制药递交的注射用重组人促甲状腺激素上市申请已获得受理。根据泽璟制药公开资料,该药本次申报上市的适应症是用于既往接受过甲状腺切除术的分化型甲状腺癌患者随访时的放射性碘(131I)全身显像(WBS)检查和血清甲状腺球蛋白(Tg)检测。该公司开发的rhTSH与人天然TSH氨基酸序列完全一致。rhTSH激活甲状腺细胞的效应是增加放射碘的摄取,可以扫描检测或者放射碘杀伤甲状腺癌细胞。rhTSH激活也可以导致甲状腺细胞释放甲状腺球蛋白,甲状腺球蛋白是血液标本中甲状腺癌的肿瘤标志物。
(3)默沙东研发21价肺炎球菌结合疫苗Capvaxive(V116)疫苗获FDA批准
6月18日,美国FDA批准默沙东专为预防成人侵袭性肺炎球菌疾病和肺炎球菌肺炎而设计的21价肺炎球菌结合疫苗Capvaxive(V116)上市,针对18岁及以上的个体进行主动免疫,以预防由肺炎链球菌(Streptococcus pneumoniae)血清型3、6A、7F、8、9N、10A、11A、12F、15A、15B、15C、16F、17F、19A、20A、22F、23A、23B、24F、31、33F和35B引起的侵袭性疾病或肺炎。Capvaxive是一种在研21价肺炎球菌结合疫苗。该疫苗专门设计用于预防主要导致成人肺炎球菌疾病的肺炎链球菌血清型,包括8种独特的血清型。Capvaxive设计为单剂给药,有助于预防成人侵袭性肺炎球菌疾病和肺炎球菌肺炎。
(4)强生向FDA递交双特异性抗体Rybrevant生物制品许可申请
6月18日,强生宣布已向美国FDA提交了生物制品许可申请(BLA),寻求批准其双特异性抗体Rybrevant(amivantamab)与重组人透明质酸酶的皮下给药固定组合,用于目前已批准或已提交的所有Rybrevant静脉制剂的适应症,以治疗某些非小细胞肺癌(NSCLC)患者。根据新闻稿,患者能够在5分钟完成该皮下制剂的注射。Rybrevant皮下制剂还显示出显著缩短的给药时间、输液相关反应减少了5倍,同时总生存期、无进展生存期和缓解持续时间更长。Rybrevant是一款人源化EGFR/MET双特异性抗体。它具有多重抗癌的作用机制,不但能够阻断EGFR和MET介导的信号传导,还可以引导免疫细胞靶向携带激活性和耐药性EGFR/MET突变和扩增的肿瘤。Rybrevant于2021年5月获得美国FDA的加速批准,并在今年3月获完全批准,用于治疗经FDA批准的检测发现EGFR外显子20插入突变、接受铂类化疗过程中或化疗后病情进展的局部晚期或转移性NSCLC成年患者。
(5)默沙东的Keytruda再获FDA批准,治疗晚期癌症
6月18日,美国FDA批准默沙东重磅PD-1抑制剂Keytruda(pembrolizumab)与卡铂和紫杉醇联用,随后单药Keytruda治疗,用于原发性晚期或复发性子宫内膜癌成人患者。根据新闻稿,Keytruda是首个获得美国FDA批准与化疗联合用于治疗原发性晚期或复发性子宫内膜癌成年患者的PD-1靶向疗法,无论患者的错配修复(MMR)状态如何。Keytruda是默沙东开发的PD-1抑制剂,可阻断PD-1与其配体PD-L1和PD-L2之间的相互作用,释放PD-1信号通路介导的免疫反应抑制,从而激活可能影响肿瘤细胞和健康细胞的T淋巴细胞,进而增强人体免疫系统发现和消灭癌细胞的能力。自在2014年首次获得FDA批准治疗晚期黑色素瘤以来,Keytruda已经获得FDA批准,治疗至少16种癌症类型,以及不限癌种的适应症。
(6)艾伯维IL-23抑制剂获FDA批准,治疗溃疡性结肠炎
6月19日,艾伯维今日宣布,美国FDA已批准Skyrizi(risankizumab)扩展适应症,用于治疗中度至重度活动性溃疡性结肠炎成人患者。新闻稿指出,这一批准使其成为首个被批准用于治疗中重度溃疡性结肠炎和中重度克罗恩病的IL-23特异性抑制剂。Skyrizi目前已被批准用于治疗四种免疫介导的炎症性疾病。Risankizumab是一种人源化、IgG1亚型的单克隆抗体,可以借由与IL-23的p19亚基结合而选择性地拮抗IL-23。IL-23是一种与炎症有关的细胞因子,被认为与许多慢性免疫疾病有关。此前,Skyrizi已获得3项FDA批准的适应症,包括克罗恩病、中重度斑块状银屑病,以及成人活跃银屑病关节炎。
(7)Aurion细胞疗法AURN001获FDA双重认定,治疗角膜水肿
6月20日,Aurion Biotech宣布,美国FDA授予其现货型细胞疗法AURN001突破性疗法认定(BTD)和再生医学先进疗法(RMAT)认定。根据新闻稿,AURN001是同时获得BTD与RMAT认定的首个同种异体细胞疗法,用于治疗角膜内皮疾病继发的角膜水肿。继发于内皮功能障碍的角膜水肿是一种危及视力的衰弱性疾病,影响着全世界数百万人。角膜内皮细胞(CEC)死亡或退化后不会再生。如果不及时治疗,角膜内皮细胞损失会导致角膜水肿和视力受损。AURN001是一种一次性前房注射细胞疗法与药物的组合,由同种异体人角膜内皮细胞neltependocel和Rho相关蛋白激酶(ROCK)抑制剂Y-27632所组成。
(8)Botanix 小分子疗法Sofdra上市,治疗多汗症
6月21日,Botanix Pharmaceuticals公司宣布,美国FDA已经批准Sofdra(sofpironium)凝胶(12.45%)上市,用于治疗9岁以上的儿童和成人原发性腋窝多汗症患者。新闻稿指出,这是FDA批准治疗这一症状的首款新分子实体。Sofpironium是一种抗胆碱能/抗毒蕈碱药物,通过与受体结合阻断出汗信号,从而抑制腺体出汗。该疗法设计为使用专有涂抹器将sofpironium以凝胶制剂的形式递送至腋下,使患者避免直接接触手上的药物。
(9)Lexicon的双重SGLT抑制剂sotagliflozin递交新药申请
6月22日,Lexicon Pharmaceuticals宣布,在与美国FDA进行多次沟通后,已重新提交在研疗法sotagliflozin的新药申请(NDA),作为胰岛素的辅助疗法,帮助1型糖尿病伴有慢性肾病(CKD)患者控制血糖。Sotagliflozin是1型和2型钠葡萄糖共转运蛋白(SGLT1和SGLT2)的口服抑制剂。SGLT1主要负责在胃肠道对葡萄糖的吸收,而SGLT2主要负责在肾脏对葡萄糖的重吸收。抑制这两种蛋白的功能可以让更多葡萄糖从尿液中排出,并且降低食物中葡萄糖的吸收,从而帮助1型糖尿病患者控制血糖水平。它在2019年获得欧盟委员会批准上市,商品名为Zynquista。去年5月,它获得美国FDA的批准,用于降低成人患者的心血管死亡、因心力衰竭而住院或接受急救的风险。这些患者患有心力衰竭,或患有2型糖尿病、慢性肾病,并携带其它心血管疾病风险因子。
(10)和黄医药和武田的呋喹替尼获欧盟批准上市,治疗转移性结直肠癌
6月22日,和黄医药和武田宣布,欧盟委员会已正式批准Fruzaqla(fruquintinib,呋喹替尼)上市,作为单药用以治疗转移性结直肠癌(mCRC)成人患者,这些患者先前已接受过现有的标准疗法治疗,包括基于氟嘧啶、奥沙利铂和伊立替康的化疗、抗VEGF药物和抗EGFR药物,并且在使用曲氟尿苷-替吡嘧啶或regorafenib治疗后病情进展或不耐受。根据新闻稿,呋喹替尼是欧盟十多年来首个针对mCRC的新型靶向疗法,无论患者的生物标志物状态如何。呋喹替尼是一种高选择性、强效的口服VEGFR-1、-2及-3抑制剂,其设计使其激酶选择性更高,旨在尽可能地降低脱靶毒性、改善耐受性及对靶点提供更稳定的覆盖。2023年3月,武田与和黄医药达成独家许可协议,在除中国大陆、香港和澳门以外的全球范围内进一步推进呋喹替尼的开发、商业化和生产。该药此前已于中国与美国获批上市。
1.5.2本周全球TOP10积极/失败临床结果
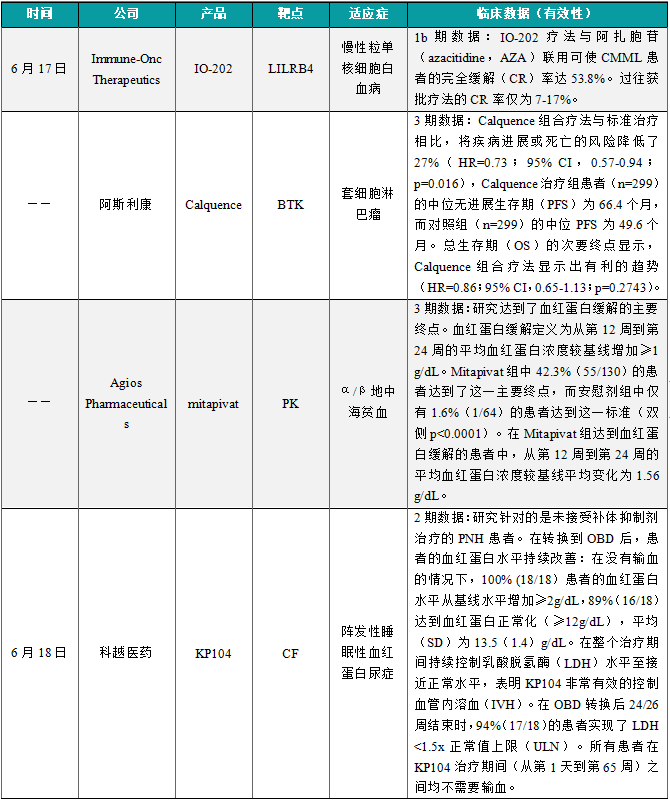

(1)Immune-Onc单抗组合疗法IO-202展现积极抗癌潜力,完全缓解率达53.8%
6月17日,Immune-Onc Therapeutics公布其在研疗法IO-202用于治疗慢性粒单核细胞白血病(CMML)患者的1b期扩展队列积极中期数据。分析显示,该疗法与阿扎胞苷(azacitidine,AZA)联用可使CMML患者的完全缓解(CR)率达53.8%。过往获批疗法的CR率仅为7-17%。CMML是一种罕见的血液系统恶性肿瘤,患者的生存率低,目前常规疗法无法治愈,且没有有效的标准治疗。IO-202是一款潜在"first-in-class"的IgG1抗体,可特异性、高亲和力地与LILRB4结合,并通过抗体依赖性细胞毒性和抗体依赖性细胞吞噬作用消除LILRB4阳性细胞。因此,IO-202是一种在血癌、自身免疫和炎症疾病方面具有广阔潜力的靶向疗法。
(2)阿斯利康BTK抑制剂Calquence组合疗法显著提高套细胞淋巴瘤患者无进展生存期
近日,阿斯利康(AstraZeneca)公司公布了其布鲁顿氏酪氨酸激酶(BTK)抑制剂Calquence(acalabrutinib)与标准化学免疫疗法联用,作为一线疗法,治疗初治套细胞淋巴瘤(MCL)患者的3期临床试验ECHO的积极结果。试验结果显示,Calquence组合疗法与标准治疗相比,将疾病进展或死亡的风险降低了27%(HR=0.73;95% CI,0.57-0.94;p=0.016),Calquence治疗组患者(n=299)的中位无进展生存期(PFS)为66.4个月,而对照组(n=299)的中位PFS为49.6个月。总生存期(OS)的次要终点显示,Calquence组合疗法显示出有利的趋势(HR=0.86;95% CI,0.65-1.13;p=0.2743)。在此次分析时,OS数据尚未成熟,试验将继续评估OS作为关键次要终点。
(3)Agios公司mitapivat口服疗法达到3期临床主要终点,今年递交监管申请
近日,Agios Pharmaceuticals介绍了其全球性3期临床试验ENERGIZE的结果,该研究评估了mitapivat在无输血依赖(NTD)的α-或β-地中海贫血成人患者中的疗效。ENERGIZE研究达到了其主要终点,mitapivat与安慰剂相比,显著提高患者血红蛋白缓解率。此外,与基线相比,FACIT-疲劳评分和血红蛋白浓度变化的关键次要终点也达到了统计学显著性。研究达到了血红蛋白缓解的主要终点。血红蛋白缓解定义为从第12周到第24周的平均血红蛋白浓度较基线增加≥1 g/dL。Mitapivat组中42.3%(55/130)的患者达到了这一主要终点,而安慰剂组中仅有1.6%(1/64)的患者达到这一标准(双侧p<0.0001)。在Mitapivat组达到血红蛋白缓解的患者中,从第12周到第24周的平均血红蛋白浓度较基线平均变化为1.56 g/dL。Mitapivat是一款“first-in-class”的口服丙酮酸激酶激活剂,它能改善血红细胞的能量供应,提高红细胞的健康水平。2022年2月,美国FDA批准了mitapivat(商品名Pyrukynd)上市,它成为首个改变疾病进程的丙酮酸激酶缺乏症疗法。
(4)科越医药的KP1042期临床研究结果公布,治疗阵发性睡眠性血红蛋白尿症
6月18日,科越医药公布了KP104治疗阵发性睡眠性血红蛋白尿症2期临床研究的长期安全性和有效性结果。KP104是一种在研双功能C5抗体/H因子融合蛋白。该研究针对的是未接受补体抑制剂治疗的PNH患者。研究要点包括了18名患者长达65周的治疗结果,在转换到OBD后,患者的血红蛋白水平持续改善:在没有输血的情况下,100% (18/18)患者的血红蛋白水平从基线水平增加≥2g/dL,89%(16/18)达到血红蛋白正常化(≥12g/dL),平均(SD)为13.5(1.4)g/dL。在OBD转换后24/26周结束时,94%(17/18)的患者实现了LDH <1.5x正常值上限(ULN)。所有患者在KP104治疗期间(从第1天到第65周)之间均不需要输血。
(5)强生nipocalimab疗法达到2期临床主要终点,治疗多种自身免疫疾病
近日,强生宣布,其靶向新生儿Fc受体(FcRn)的在研抗体疗法nipocalimab在一项针对成人干燥综合征(Sjögren’s disease,SjD)患者的2期临床试验DAHLIAS中达到试验主要终点。接受nipocalimab治疗的患者在第24周与基线相比,其ClinESSDAIa评分显示出统计学显著(P=0.002)和具有临床意义的改善。与安慰剂组相比也达到同样疗效。新闻稿指出,这些数据代表了nipocalimab治疗SjD的首个积极临床试验结果。这款疗法今年年初被行业媒体Evalute列为10大潜在重磅在研疗法之一。Nipocalimab是一款潜在“best-in-class”,靶向FcRn的抗体疗法。它通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会重新释放到血液中,而是在细胞内被降解。已有研究显示,它可以将血液循环中包括致病自身抗体在内的IgG水平降低超过75%。这款抗体疗法有望治疗多种自身抗体介导的免疫疾病。
(6)Nurix公布NX-5948在1a/b期临床试验结果,客观缓解率达70%
近日,Nurix Therapeutics公布其在研口服布鲁顿酪氨酸激酶(BTK)降解剂NX-5948在1a/b期临床试验的积极数据。分析显示,NX-594在复发难治性慢性淋巴细胞白血病(CLL)患者身上引起快速、深度的缓解,客观缓解率(ORR)达近70%,这些患者之前曾接受大量治疗并带有BTK抑制剂耐药突变。在可评估疗效的CLL患者(n=26)中,接受所有剂量水平NX-5948治疗患者的ORR达69.2%,最早在第一次肿瘤扫描(8周)时就观察到患者出现缓解,许多患者在治疗时间延长后缓解加深,无论既往治疗、基线突变或CNS受累情况如何,所有人群均观察到缓解。Nurix预计在2025年启动NX-5948的关键临床试验。
(7)Mustang公布CAR-T细胞疗法MB-106的1/2期数据,90%患者达成缓解
近日,Mustang Bio公司公布其在研CAR-T细胞疗法MB-106进行中的1/2期临床试验最新数据。MB-106是一款靶向CD20的自体CAR-T细胞疗法,可通过门诊给药。MB-106由Mustang Bio和Fred Hutchinson癌症中心合作开发,用于治疗复发或难治性B细胞非霍奇金淋巴瘤(B-NHL)和慢性淋巴细胞白血病(CLL)患者。分析显示,接受该疗法的华氏巨球蛋白血症(WM)患者的总缓解率(ORR)高达90%,其中一位患者持久完全缓解达31个月,这些患者在治疗前均接受过大量前期治疗。试验中的所有十例患者均曾接受过布鲁顿酪氨酸激酶抑制剂(BTKi)的治疗,并且在接受BTKi治疗期间病情持续恶化。患者之前接受过中位9线疗法,只有一例患者在接受MB-106治疗后开始接受额外的抗WM治疗。总体而言,接受MB-106治疗的患者中有90%(9/10)对治疗产生应答,包括3名患者达完全缓解、2名达非常好的部分缓解和4名部分缓解。此外,1例患者的病情稳定。其中一名获得完全缓解的患者已持续缓解31个月,该患者的免疫球蛋白M(IgM)水平在接受MB-106治疗后迅速降至正常范围,此后一直保持正常。
(8)Woolsey的Bravyl在治疗肌萎缩侧索硬化症中2a期临床结果积极
6月20日,Woolsey Pharmaceuticals公司宣布,其在研药物Bravyl在治疗肌萎缩侧索硬化症(ALS)的2a期临床研究REAL中耐受性良好,并且显著降低血液中关键生物标志物神经丝轻链(NfL)的水平。Bravyl在24周的治疗后显著降低了患者生物标志物NfL的水平。NfL是神经细胞轴突骨架损伤的敏感且特异性标志物。血液中NfL水平升高已被证明是ALS疾病进展速度的可靠指标。试验数据显示,从基线到6个月观察到NfL显著下降15%(p<0.001)。由于在ALS人群中NfL在6个月内平均增加11%,这表明180 mg/天的Bravyl在6个月内相对于安慰剂组可潜在减少NfL高达26%。Bravyl是一款fasudil的口服剂型,fasudil是一种强力的Rho激酶(ROCK)抑制剂。它通过抑制ROCK活性,可能对抗神经退行性病变并促进神经元再生。
(9)Zealand公布减重疗法petrelintide积极结果,16周减重8.6%
6月21日,Zealand Pharma公布其在研长效、潜在“best-in-class”减重疗法petrelintide在多次剂量递增(MAD)1b期试验第二部分的顶线结果。Petrelintide(ZP8396)是一种适合每周一次皮下注射的长效胰淀素类似物,具有中性pH下的化学和物理稳定性。分析显示,共包含48名(约80%男性)中位年龄为49岁、中位体重为92.4公斤、中位基线BMI为29 kg/m²的受试者。受试者被随机分配接受16周三个剂量的petrelintide或安慰剂治疗。与基线相较,完成高剂量petrelintide治疗受试者的平均体重下降了8.6%,而安慰剂组的平均体重则下降了1.7%。新闻稿指出,该积极结果支持petrelintide作为GLP-1受体激动剂类药物之外,在体重管理上另一选择。Zealand预计将在2024年下半年启动2b期临床试验。
(10)Tempest公布其在研PPAR⍺拮抗剂amezalpat临床结果,延长总生存期6个月
6月21日,Tempest Therapeutics公司宣布,其在研PPAR⍺拮抗剂amezalpat(TPST-1120)在一项全球随机的1b/2期临床试验中获得积极结果。Amezalpat是一种口服、选择性PPARα小分子拮抗剂。分析显示,与标准治疗方案相比,Amezalpat组的中位OS为21个月,对照组为15个月。Amezalpat提供了6个月的生存优势。Amezalpat组中有20/40名患者仍在生存期的随访中,而对照组中仅有9/30名患者。两组间OS的风险比(HR)为0.65,自10个月前的顶线分析以来,HR保持稳定,当时HR为0.59。药物具有可控的安全性,与之前数据一致。
同期事件:
1. 2024年第25周06.17-06.23国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第25周06.17-06.23国内仿制药/生物类似物申报/审批数据分析
3. 2024年第25周06.17-06.23国内医药大健康行业政策法规汇总
4. 2024年第25周06.17-06.23全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.06.17-2024.06.23)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论