1.5.1 本周全球TOP10创新药研发进展
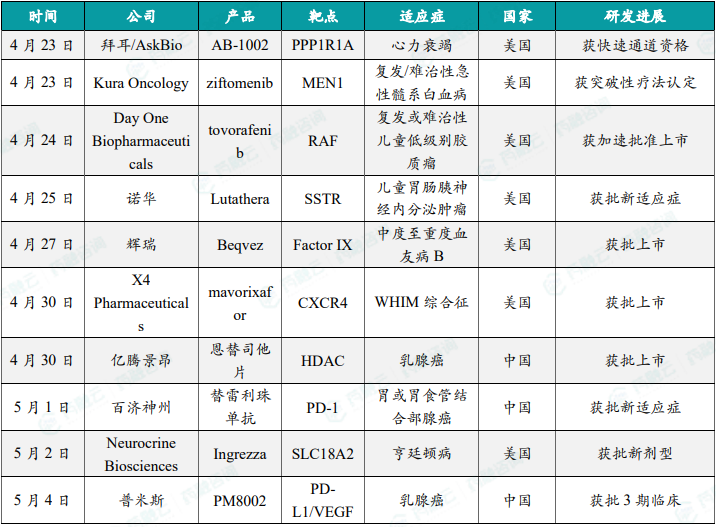
拜耳充血性心力衰竭在研基因疗法获美国FDA快速通道资格
4月23日,拜耳(Bayer)集团及其全资独立运营子公司Asklepios BioPharmaceutical(AskBio)宣布,美国FDA已授予AB-1002项目快速通道资格。AB-1002是一种在研的一次性给药基因疗法,作用于心脏,旨在促进产生蛋白质抑制剂1(I-1c)的组成型活性形式,阻断蛋白磷酸酶1的作用,抑制这种与充血性心力衰竭(CHF)有关的蛋白质的功能可能产生治疗作用。公司目前正在进行GenePHIT(基因磷酸酶抑制疗法)临床2期试验的患者招募,GenePHIT是一项2期适应性、双盲、安慰剂对照、随机、多中心试验,旨在评估患有非缺血性心肌病伴有纽约心脏病协会(NYHA)III级心衰症状的18岁以上男性和女性患者,通过一次性冠状动脉内输注AB-1002的安全性和有效性。
Kura Oncology小分子药物ziftomenib获美国FDA突破性疗法认定
4月23日,Kura Oncology公司宣布,其在研疗法ziftomenib已经获得美国FDA授予的突破性疗法认定,用于治疗携带NPM1基因突变的复发/难治性急性髓系白血病(AML)患者。Ziftomenib是一种针对menin与KMT2A/MLL蛋白复合体之间相互作用的候选药物,用于治疗有高度未满足需求,携带特定基因突变的AML患者。这一突破性疗法认定是基于正在进行的临床试验KOMET-001的数据,数据显示,在新确诊的NPM1突变型和KMT2A重排型AML患者中,接受ziftomenib联合标准治疗的完全缓解(CR)率为100%;未接受过menin抑制剂治疗的难治/复发(R/R)性AML患者接受ziftomenib联合标准治疗,完全缓解或完全缓解伴部分血液学恢复(CRh)率为56%。新闻稿指出,ziftomenib是首款针对这一患者群体获得突破性疗法认定的在研疗法。
Day One Biopharmaceuticals泛RAF激酶抑制剂tovorafenib获FDA加速批准上市
4月24日,美国FDA宣布已加速批准Day One Biopharmaceuticals所开发的泛RAF激酶抑制剂Ojemda(tovorafenib)上市,用于治疗6个月及以上的复发或难治性儿童低级别胶质瘤(pLGG)患者,这些患者存在BRAF融合或重排,或BRAF V600突变。Tovorafenib是一款高度特异性泛RAF激酶抑制剂,它能够抑制携带BRAF融合或BRAF V600突变的肿瘤的生长,并且具有大脑渗透性。此次FDA批准tovorafenib主要是基于FIREFLY-1临床2期试验的数据,数据显示,在采用RANO高级别胶质瘤评估标准(RANO-HGG)评估时,tovorafenib实现了67%的总缓解率(ORR);而在采用RAPNO低级别胶质瘤评估标准(RAPNO-LGG)评估时,ORR达到51%;在采用RANO低级别胶质瘤评估标准(RANO-LGG)评估时,ORR为53%。根据美国FDA的新闻稿,这是FDA首次批准一种全身疗法,用于治疗携带BRAF重排(包括融合)变异的儿童低级别胶质瘤患者。
诺华放射性配体疗法Lutathera获FDA批准用于治疗GEP-NET儿童患者
4月25日,诺华(Novartis)宣布,美国FDA批准其放射性配体疗法Lutathera(Lu 177 dotatate)用于治疗12岁及以上的生长抑素受体阳性(SSTR+)胃肠胰神经内分泌肿瘤(GEP-NET)的儿童患者,其中包括前肠、中肠和后肠神经内分泌肿瘤。Lutathera是一款放射性配体药物,能结合肿瘤细胞表面的生长抑素受体进入细胞,通过放射性对肿瘤细胞造成损伤,在2018年获得美国FDA批准治疗经治SSTR阳性的GEP-NET患者,是首款FDA批准的放射性配体疗法。此次Lutathera的批准主要基于NETTER-P试验结果,该试验评估了Lutathera对12至18岁以下SSTR+ GEP-NET患者的作用,该试验分析显示Lutathera的安全性与NETTER-1试验中的成年患者一致,NETTER-1是支持Lutathera在成人中获批的关键3期试验。根据新闻稿,此次批准使Lutathera成为首个获批用于治疗GEP-NET儿童患者的疗法。
辉瑞中重度血友病B基因疗法Beqvez获FDA批准上市
4月27日,辉瑞(Pfizer)宣布,美国FDA已批准其所开发的一次性基因疗法Beqvez(fidanacogene elaparvovec)用于治疗18岁或以上中度至重度血友病B成人患者,这些患者正在接受凝血因子IX(FIX)预防治疗,或目前或过去有危及生命的出血,或反复发生严重的自发性出血事件。Beqvez是一种新型的在研基因疗法,含有生物工程化的腺相关病毒衣壳和FIX基因的高活性变体,对于血友病B的基因治疗目标是使患者通过一次性治疗产生自体的FIX蛋白,而非像目前的标准治疗那样需要定期静脉输注FIX。美国FDA批准Beqvez主要是基于单组、开放标签临床3期试验BENEGENE-2的结果,根据该结果,BENEGENE-2试验达到其主要终点,即与FIX预防性治疗方案相较,患者在经过Beqvez输注后,其总出血事件的年化出血率(ABR)达到非劣效性与优效性。加拿大卫生部(Health Canada)于今年1月批准Beqvez上市,目前欧洲药品管理局(EMA)正在进行该疗法的审评。
X4 Pharmaceuticals突破性小分子疗法获FDA批准上市,针对WHIM综合征
4月30日,X4 Pharmaceuticals公司宣布,美国FDA已批准Xolremdi(mavorixafor)胶囊上市,用于治疗12岁及以上患有WHIM综合征的患者,以增加血液循环中成熟中性粒细胞和淋巴细胞的数量。Xolremdi是一种选择性CXC趋化因子受体4(CXCR4)拮抗剂。WHIM综合征是一种罕见的原发性免疫缺陷和慢性中性粒细胞减少症,由CXCR4信号通路障碍引起,患者典型表现为中性粒细胞和淋巴细胞水平低,经常出现严重或频繁的感染。FDA的批准基于3期临床试验4WHIM的结果,根据该结果,与安慰剂相比,Xolremdi治疗显著增加了绝对中性粒细胞计数(ANC)水平超过阈值(≥500细胞/微升)和ALC水平超过阈值(≥1000细胞/微升)的持续时间,p值均小于0.0001,此外,Xolremdi治疗组的总感染评分(根据严重程度调整)减少了约40%,Xolremdi治疗还使年化感染率相比安慰剂组降低了60%。新闻稿指出,这是首款专门针对WHIM综合征患者的获批疗法。此前,这款疗法曾获得FDA授予的突破性疗法认定。
亿腾景昂口服乳腺癌新药恩替司他片获NMPA批准上市,针对乳腺癌
4月30日,亿腾景昂宣布其1类创新药恩替司他片新药上市申请获中国国家药品监督管理局(NMPA)正式批准,适应症为联合芳香化酶抑制剂用于治疗激素受体(HR)阳性、人类表皮生长因子受体2阴性(HER2-),经内分泌治疗复发或进展的局部晚期或转移性乳腺癌患者。恩替司他是一种新型、口服的HDAC抑制剂,通过选择性抑制I类HDAC,特别是针对有代表性的HDAC 1、2、3亚型,从而调节组蛋白的超乙酰化并促进特定基因的转录活化,最终抑制细胞增殖、加快终末分化和/或诱导凋亡。此外,恩替司他片凭借半衰期较长的独特特性,实现了一周一次的临床给药方式,极大的提高了患者服药依从性降低了患者用药成本,使其进一步区分于其他HDAC抑制剂。
百济神州PD-1抑制剂胃或胃食管结合部腺癌适应症在中国获批上市
5月1日,百济神州宣布,其PD-1抑制剂替雷利珠单抗获得中国国家药品监督管理局(NMPA)批准,联合氟尿嘧啶类和铂类药物化疗用于局部晚期不可切除的或转移性的胃或胃食管结合部(G/GEJ)腺癌的一线治疗。本次获批基于RATIONALE-305试验的最终分析结果,研究结果显示,在全球意向性治疗ITT人群中,替雷利珠单抗联合化疗组的mOS达15.0个月,显著降低死亡风险20%,其中中国人群的mOS达15.7个月。根据百济神州新闻稿介绍,此前于2023年2月,替雷利珠单抗已获批用于联合氟尿嘧啶类和铂类药物化疗用于PD-L1高表达的局部晚期不可切除的或转移性的胃或胃食管结合部腺癌的一线治疗。本次获批进而验证了无论PD-L1表达如何,替雷利珠单抗联合化疗作为晚期胃癌的一线治疗均可使患者获益。
Neurocrine亨廷顿病疗法Ingrezza口服颗粒剂型在美国获批上市
5月2日,Neurocrine Biosciences日前宣布,美国FDA批准了其亨廷顿病疗法Ingrezza(valbenazine)的新剂型,这一新剂型给吞咽药片困难的亨廷顿病患者提供了一种替代服药方式。这种名为Ingrezza Sprinkle的新剂型是一种口服颗粒,可以撒在患者吃的软食物上,与食物一起服用,Ingrezza Sprinkle的剂量和生物利用度与已经获批的Ingrezza相同。Ingrezza是一款选择性囊泡单胺转运蛋白2(VMAT2)抑制剂,已经获得FDA的批准治疗与亨廷顿病相关的迟发性运动障碍,在亨廷顿病患者中,与疾病相关的不自主运动可能让吞咽药片变得困难。
普米斯PD-L1/VEGF双抗获批3期临床试验,一线治疗三阴性乳腺癌
5月4日,普米斯宣布其自主研发的抗PD-L1/VEGF双特异性抗体新药PM8002注射液获中国国家药品监督管理局药品审评中心(CDE)批准开展一项多中心、随机、双盲注册性3期临床试验,针对的适应症为——PM8002注射液或安慰剂联合注射用白蛋白结合型紫杉醇一线治疗不可手术的局部晚期/复发转移性三阴性乳腺癌。PM8002是一款双特异性抗体药物,由人源化的抗PD-L1单域抗体(VHH)融合到一个含有Fc-沉默突变的抗VEGF-A IgG1抗体上构成,现已在中国开展针对三阴性乳腺癌、小细胞肺癌、非小细胞肺癌、宫颈癌等多个癌种的多项2期临床研究。根据普米斯于圣安东尼奥乳腺癌大会(SABCS)2023年会上展示的临床数据,PM8002联合白蛋白紫杉醇方案在晚期三阴性乳腺癌的一线治疗中显示出令人鼓舞的抗肿瘤活性和良好的安全性,患者的客观缓解率(ORR)达78.6%,疾病控制率(DCR)达95.2%。
1.5.2本周全球TOP10积极/失败临床结果
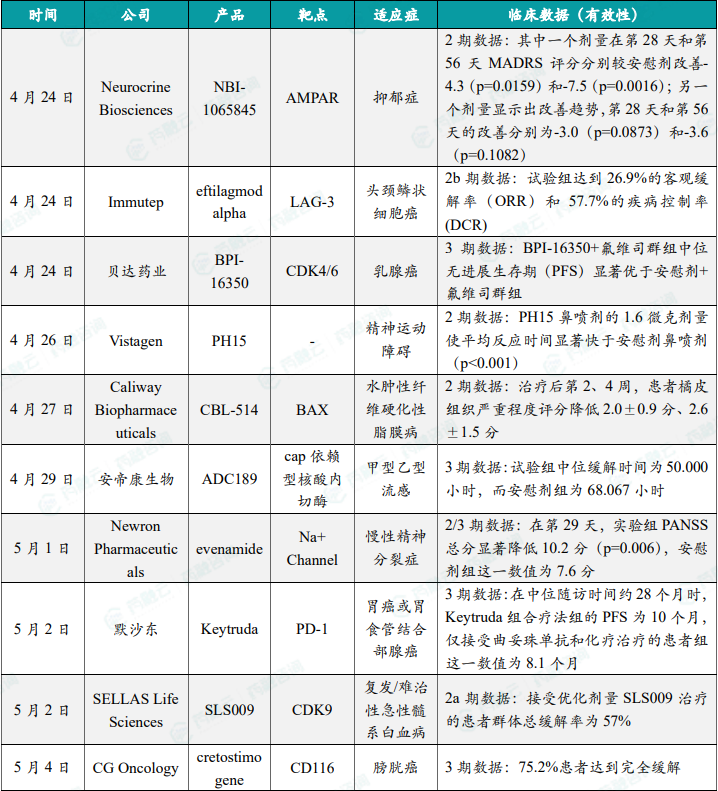
Neurocrine Biosciences 在研疗法NBI-1065845达到2期临床终点,显著缓解抑郁症
4月24日,Neurocrine Biosciences公司宣布,在研疗法NBI-1065845在治疗抑郁症(MDD)成年患者的2期临床试验SAVITRI中获得积极顶线数据。NBI-1065845是一款潜在“first-in-class”的AMPA受体正向别构调节剂(PAM),旨在治疗在抑郁发作中至少对一种抗抑郁药没有应答的MDD患者。根据2期数据,NBI-1065845在第28天(主要终点)和第56天(次要终点)的蒙哥马利-阿斯伯格抑郁评分量表(MADRS)总分上均显示出统计学上显著的改善,其中一个剂量在第28天和第56天分别较安慰剂改善了-4.3(p=0.0159)和-7.5(p=0.0016),另一个剂量显示出改善趋势,第28天和第56天的改善分别为-3.0(p=0.0873)和-3.6(p=0.1082)。NBI-1065845的耐受性总体良好,头痛是最常见的不良事件,两个剂量的不良事件情况与安慰剂组相当。
Immutep 公司LAG-3靶向疗法联合PD-1抑制剂2b期试验结果积极,针对头颈鳞状细胞癌
4月24日,Immutep公司公布了2b期试验TACTI-003(KEYNOTE-PNC-34)队列B 的初步顶线结果。该试验旨在评估eftilagmod alpha(efti)联合默沙东(MSD)抗PD-1抗体Keytruda(pembrolizumab)一线治疗PD-L1阴性的复发/转移性头颈鳞状细胞癌患者的疗效。Efti为一种可溶性LAG-3融合蛋白和MHC II类激动剂,可通过刺激先天免疫和适应性免疫来治疗癌症。2b期试验结果显示,在26名不表达PD-L1的肿瘤患者中,接受 Immutep公司的可溶性LAG-3蛋白efti和默沙东的抗PD-1抗体组合的患者,达到了26.9%的客观缓解率(ORR)和57.7%的疾病控制率(DCR)。根据Immutep公司新闻稿,TACTI-003的数据收集、清理和分析仍在继续。
贝达药业CDK4/6抑制剂3期临床取得积极结果,针对乳腺癌
4月24日,贝达药业发布公告称,该公司自主研发的产品BPI-16350(酒石酸泰贝西利胶囊)完成3期临床试验,并取得临床试验总结报告。这是一款以CDK4/6为靶点的新分子实体化合物,本次完成的3期临床研究针对适应症为联合氟维司群,用于既往接受内分泌治疗后进展的激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性的局部晚期或晚期复发转移性乳腺癌患者。3期临床研究结果显示,基于研究者评估,BPI-16350+氟维司群组用于既往接受内分泌治疗后进展的HR+/HER2-的局部晚期或晚期复发转移性乳腺癌治疗,中位无进展生存期(PFS)显著优于安慰剂+氟维司群组。独立疗效委员会(IREC)和研究者评估的PFS结论一致。同时,BPI-16350+氟维司群组受试者安全性良好。
Vistagen在研pherine鼻喷剂2期临床结果积极,改善精神疲劳引起的精神运动障碍
4月26日,Vistagen宣布,在研疗法PH15在正在进行的2A期临床试验中获得积极结果,PH15是一种在研pherine鼻喷剂,旨在改善因精神疲劳(mental fatigue)引起的精神运动障碍。Pherine是一类新的聚焦于神经回路的候选药物,通过鼻内给药用于治疗精神病和神经系统疾病。它的作用机制独特,通过激活鼻部化学感受器,将信号通过神经回路传送到特定的大脑区域,与所有已批准药物的作用机制截然不同。根据试验结果,在所有测试点,PH15鼻喷剂的1.6微克剂量使平均反应时间显著快于安慰剂鼻喷剂(p<0.001)。此外,在参与者疲劳最为严重的午夜和凌晨3:00的测试时段,PH15在改善反应时间方面的表现也显著优于口服咖啡因(p<0.001)。PH15的耐受性良好,未报告任何严重不良事件。
Caliway潜在“first-in-class”小分子疗法CBL-514临床2期试验结果积极
4月27日,Caliway Biopharmaceuticals宣布其潜在“first-in-class”小分子疗法CBL-514在临床2期试验CBL-0201EFP的积极顶线结果。CBL-514是一种脂肪分解注射剂,为潜在的“first-in-class”小分子药物,可以诱导脂肪细胞凋亡和脂肪分解以减少治疗区域的皮下脂肪沉积,同时不会对中枢神经系统、心血管系统以及呼吸系统造成任何系统性副作用。CBL-0201EFP试验是一项开放标签2期研究,旨在评估CBL-514皮下注射液治疗水肿性纤维硬化性脂膜病(EFP,即橘皮组织)的安全性、耐受性和有效性。结果显示,治疗后第2和4周,使用改良的Hexsel橘皮组织严重程度量表进行的评估显示,患者平均评分分别降低了2.0±0.9分(p=0.00049,95% CI:-2.77,-1.23)和2.6±1.5分(p=0.00169,95% CI:-3.88,-1.37),在第12周进行最后一次CBL-514治疗时,超过50%受试者的橘皮组织严重程度至少有一个级别的改善,此外,该药物同时展现良好的安全性与耐受性。
安帝康生物抗流感新药玛氘诺沙韦片3期临床取得成功
4月29日,安帝康生物宣布,其抗流感新药玛氘诺沙韦片(ADC189)治疗成人、青少年甲型乙型流感的3期临床试验研究达到主要终点。玛氘诺沙韦是安帝康生物自主设计、自主研发的一款1类创新药物,临床上拟用于2岁以上甲型乙型流感的治疗。作为一款cap依赖型核酸内切酶抑制剂,玛氘诺沙韦可抑制流感病毒中cap依赖型核酸内切酶,从而阻断病毒自身mRNA的转录,使其失去自我复制能力,从根源对病毒实施精准打击。3期试验数据显示,在基于ITTI的主要终点指标——7项流感症状缓解时间方面,玛氘诺沙韦组的中位缓解时间为50.000小时,而安慰剂组为68.067小时,玛氘诺沙韦组的中位缓解时间较安慰剂组改善了26.543%,差异具有统计学极显著性意义(P<0.0001)。
Newron精神分裂症创新小分子疗法达到2/3期临床主要终点
5月1日,Newron Pharmaceuticals公司宣布,其潜在关键性临床试验008A取得了积极的顶线结果,该研究评估了在研新分子实体evenamide治疗慢性精神分裂症患者的安全性、耐受性和有效性,这些患者目前正接受包括氯氮平(clozapine)在内的第二代抗精神病药物治疗,但对治疗应答不足。Evenamide是一种口服的新化学实体,特异性靶向电压门控钠离子通道,用于治疗精神分裂症,根据2/3期临床结果,将30毫克(每日两次)的evenamide添加到患者当前的抗精神病药物中,在第29天,将PANSS总分显著降低了10.2分(p=0.006),安慰剂组这一数值为7.6分,此外,Evenamide表现出良好的安全性和耐受性,试验完成率高。Newron指出,evenamide有望成为自氯氮平在1989年获批以来,首款针对治疗抵抗性精神分裂症的新疗法。
默沙东重磅PD-1抑制剂Keytruda一线免疫组合疗法达到3期临床主要终点
5月2日,默沙东公司宣布,其重磅PD-1抑制剂Keytruda在3期临床试验KEYNOTE-811中达到主要终点,与抗HER2抗体曲妥珠单抗和化疗联用,作为一线疗法治疗HER2阳性,不可切除的局部晚期或转移性胃癌或胃食管结合部(GEJ)腺癌。中期分析结果显示,这一Keytruda组合疗法也达到了KEYNOTE-811的另一个主要终点,在中位随访时间为约28个月时,Keytruda组合疗法组的PFS为10个月,仅接受曲妥珠单抗和化疗治疗的患者组这一数值为8.1个月,添加Keytruda将患者疾病进展或死亡风险降低28%。此前,美国FDA已经基于这一试验的客观缓解率(ORR)和缓解持续时间数据,加速批准Keytruda组合疗法一线治疗这些患者,今天公布的积极数据有望支持将加速批准转化为完全批准。Keytruda是默沙东开发的PD-1抑制剂,目前已经获得FDA批准,治疗至少16种癌症类型,以及不限癌种的适应症。在胃癌领域,除了与曲妥珠单抗和化疗联用,一线治疗HER2阳性胃癌之外,Keytruda与化疗联用也获得FDA的批准,作为一线疗法治疗HER2阴性胃癌或GEJ腺癌。
SELLAS精准抗癌疗法CDK9抑制剂2期临床结果积极
5月2日,SELLAS Life Sciences公司今日宣布,在研高度选择性CDK9抑制剂SLS009在2a期临床试验中获得积极初步结果。在携带ASXL1突变的复发/难治性急性髓系白血病(r/r AML)患者中,接受优化剂量SLS009治疗的群体达到100%的缓解率。这项2a期临床试验旨在评估SLS009治疗r/r AML患者的疗效和安全性,截至2024年4月19日,接受优化剂量SLS009治疗的患者群体总缓解率为57%,其中4名携带ASXL1截短突变的患者均获得缓解并且仍然活着,对此前1期临床试验中一名完全缓解时间超过8个月患者的基因突变分析显示,这名患者同样携带ASXL1突变。新闻稿表示,这一数据支持该公司与美国FDA接洽,讨论在这一患者群体中使用加速批准通道加快SLS009的开发和审评。
CG Oncology在研溶瘤病毒疗法cretostimogene 3期临床结果积极
5月4日,CG Oncology公司宣布,其在研溶瘤病毒疗法cretostimogene,在治疗对卡介苗(BCG)无应答的高风险非肌层浸润性膀胱癌(NMIBC)患者的3期临床试验中获得积极结果。Cretostimogene是一款膀胱灌注给药的溶瘤病毒免疫疗法,给药方式与卡介苗治疗相似。它基于一个改造的5型腺病毒(Ad5)骨架,包含了一个肿瘤特异性启动子,并且携带表达粒细胞-巨噬细胞集落刺激因子(GM-CSF)的转基因。3期临床试验结果显示,75.2%患者达到完全缓解(95% CI,65%-83%),截至2024年4月1日,中位缓解持续时间尚未达到,92.4%的患者无需接受膀胱切除术仍然存活。安全性方面,没有3级以上治疗相关不良事件(TRAE)或死亡,2名患者(1.8%)出现2级TRAE,没有出现cretostimogene相关的治疗中断。根据新闻稿,这款疗法已经被美国FDA授予突破性疗法认定和快速通道资格。
同期事件:
1.2024年第18周04.22-5.05国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2.2024年第18周04.22-5.05国内仿制药/生物类似物申报/审批数据分析
3.2024年第18周04.22-5.05国内医药大健康行业政策法规汇总
4.2024年第18周04.22-5.05全球医药大健康行业投融资数据
以上内容均来自{药融云医药行业观察周报(2024.04.22-2024.05.05)},如需查看或下载报告,可点击!
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论