
据《药融云全球在研新药与靶点月报》显示,2023年开年首月,国内共有110款新药获批临床(共计188个受理号),其中包括50款化药,57款生物制品,3款中药。更大喜讯,本月有5款新药获批上市,分别是艾迪药业的艾诺米替片(复方ACC007片)、武田中国的琥珀酸莫博赛替尼胶囊、罗氏的注射用维博妥珠单抗、诺华的琥珀酸利柏西利片、长春百克生物的带状疱疹减毒活疫苗,这些新药获批上市可为国内艾滋病、带状疱疹、癌症患者带来新的可用药物。

截图来源:《药融云全球在研新药与靶点月报》
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药。获批上市新药不包括生物类似物,新适应症、新剂型。(2)更多信息如获批临床品种全球上市及研发进展、相关靶点全局分析等,可通过药融云(www.pharnexcloud.com/?zmt-mhwz)全球研发数据库进行查询。
一、首个国产三合一抗艾滋病新药!艾迪药业「艾诺米替片」,一天仅需服用一片
2023年1月4日,根据NMPA发布的工作动态显示,国家药监局批准江苏艾迪药业公司申报的1类创新药艾诺米替片(商品名:复邦德,研发代号:ACC008)上市,用于治疗成人HIV-1(艾滋病)感染初治患者。据药融云数据库统计,艾迪药业递交的艾诺米替片新药上市申请于2021年5月20日获CDE承办,到此次新药获批上市,总共用时595天。
艾诺米替片审评时间轴(部分,微信搜索"药融云小程序"进行相关更多数据查询)

截图来源:药融云中国药品审评数据库
公开资料显示,艾诺米替片的核心成分为艾诺韦林,该药属于新一代非核苷类逆转录酶抑制剂,通过非竞争性结合并抑制HIV逆转录酶活性,从而阻止病毒转录和复制。在中国,2021年6月,艾诺韦林以1类新药获批上市,用于与核苷类抗逆转录病毒药物联合使用,治疗成人HIV-1感染初治患者,当年即被纳入《中国艾滋病诊疗指南(2021版)》推荐。
艾诺米替片是在艾诺韦林的基础上,联合2个核苷类逆转录酶抑制剂(拉米夫定和替诺福韦)开发的国产首款三合一单片复方创新药制剂,于2019年12月被列入国家十三五“重大新药创制”科技重大专项,是首个获批新药上市的三合一抗艾滋病国产药,HIV患者每天仅需服用1片,无需再服用其它抗艾滋病药物,是我国抗病毒药物研发的又一重要里程碑。
艾诺米替片国内登记的临床试验
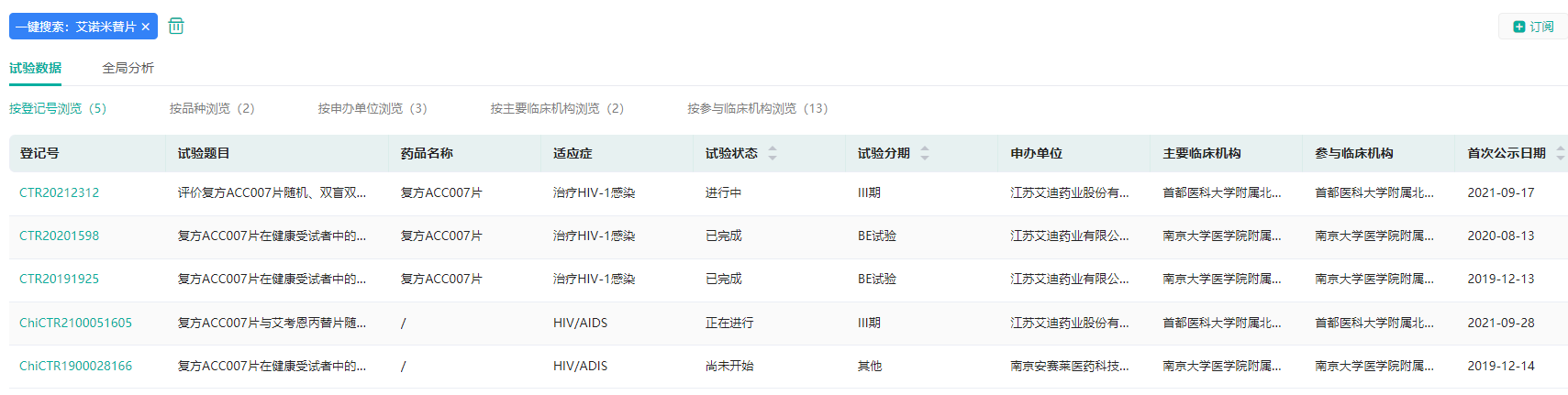
截图来源:药融云中国临床试验数据库
二、全球首个!武田「莫博赛替尼」,让NSCLC生存期突破20个月成为可能
2023年1月11日,根据NMPA发布的工作动态显示,国家药品监督管理局通过优先审评审批程序附条件批准武田制药公司申报的琥珀酸莫博赛替尼胶囊(商品名:安卫力/EXKIVITY)上市。适用于含铂化疗期间或之后进展且携带表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者。
公开资料显示,莫博赛替尼(mobocertinib)是一种靶向EGFR第20外显子插入突变的不可逆的酪氨酸激酶抑制剂。2021年9月15日,琥珀酸莫博赛替尼胶囊在美国获得加速批准上市,是全球首个且目前唯一获批专为EGFR20号外显子插入突变晚期非小细胞肺患者研发的口服靶向药物,开创靶向治疗新纪元。该新药获批上市,将为携带EGFR ex20ins突变的晚期NSCLC患者提供了新的治疗选择,让生存期突破20个月成为可能。
莫博赛替尼药物信息(部分)

截图来源:药融云全球药物研发数据库
药融云数据显示,在中国,2020年9月,琥珀酸莫博赛替尼胶囊在中国被药品审评中心指定为突破性治疗产品。2021年5月,再次被拟纳入优先审评。本次新药获批上市主要是基于其全球I期、II期以及EXCLAIM延展队列研究。研究结果显示,莫博赛替尼为患者带来了较为显著的生存获益和缓解持续时间延长,且一天一次口服,依从性高,且安全性良好。
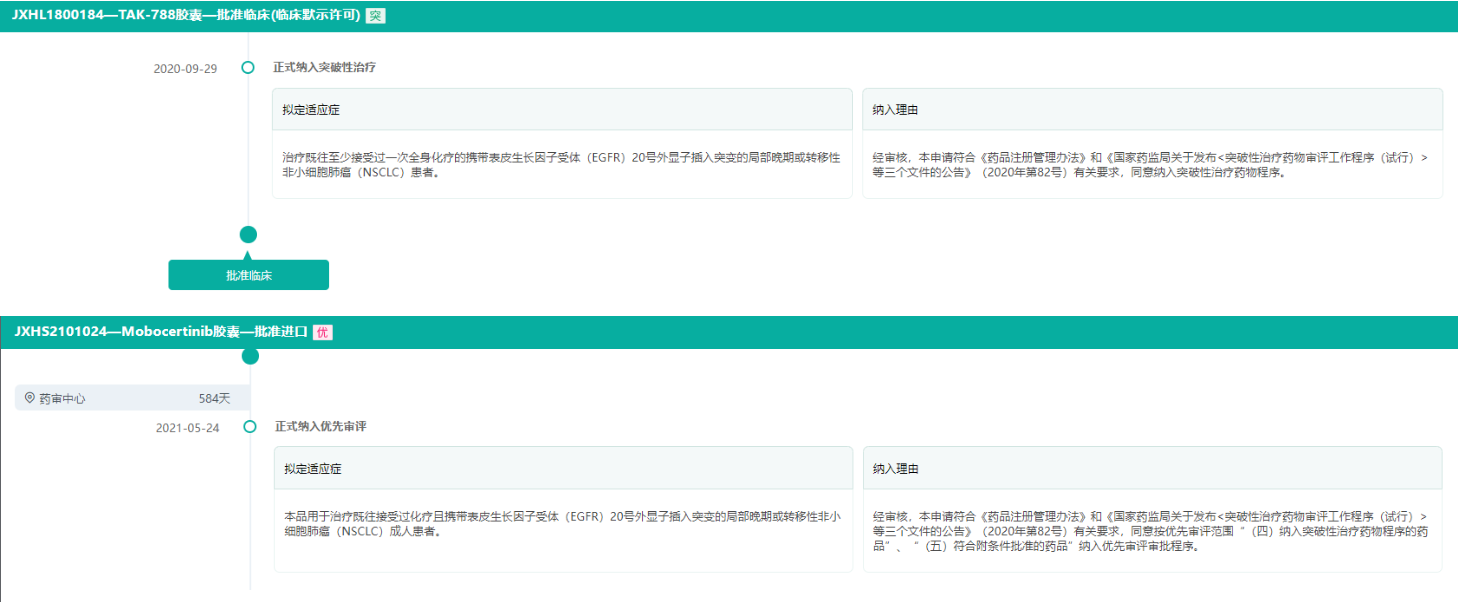
截图来源:药融云中国药品审评数据库
三、双喜临门!罗氏ADC疗法「维博妥珠单抗」获批两项适应症
2023年1月13日,根据NMPA发布的药品批准证明文件送达信息显示,国家药品监督管理局批准罗氏公司申报的靶向CD79b的抗体偶联药物(ADC)注射用维博妥珠单抗上市。
公开资料显示,注射用维博妥珠单抗此次新药获批上市,共包括两项适应症,分别为:联合利妥昔单抗、环磷酰胺、多柔比星和泼尼松,适用于治疗既往未经治疗的弥漫性大B细胞淋巴瘤(DLBCL)成人患者;联合苯达莫司汀和利妥昔单抗,用于不适合接受造血干细胞移植的复发或难治性DLBCL(R/RDLBCL)成人患者。
维博妥珠单抗研发现状
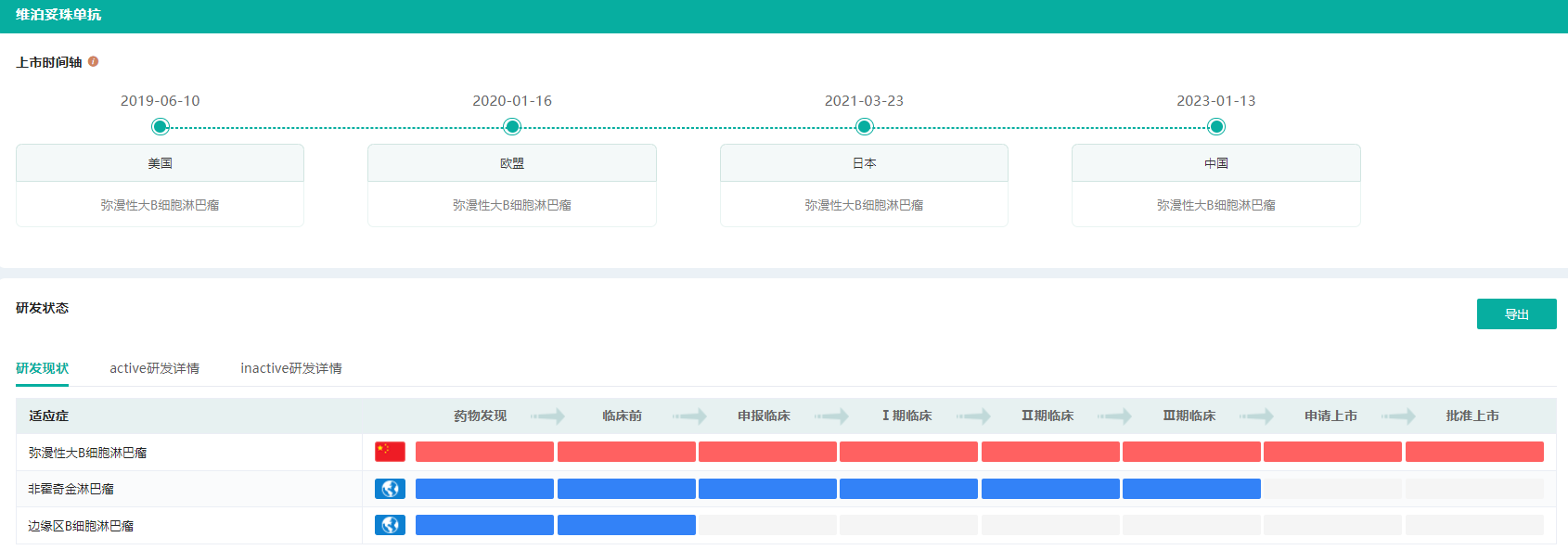
截图来源:药融云全球药物研发数据库
维博妥珠单抗是一款靶向CD79b的“first-in-class”ADC药物,它通过与肿瘤细胞上的CD79b特异性结合,递送抗癌药物杀死这些B细胞,并能够减少对正常细胞的伤害。据介绍,维泊妥珠单抗的抗体对于B淋巴瘤细胞表面表达的CD79b抗原具有高亲和力,可实现精准定位。独有的治疗靶点、独特的作用机制和创新的药物结构使该药拥有精准、高效的治疗优势。
药融云数据显示,CDE先后受理了四项注射用维博妥珠单抗的新药上市申请,其中两项上市申请于2022年1月被CDE纳入优先审评,用于治疗复发或难治性弥漫大B细胞淋巴瘤成人患者。据统计,罗氏的维博妥珠单抗自2019年在美国首次新药获批上市后,销售额就一路高歌猛进,第二年就迅速突破了亿元大关,2021年保持着95.4%的高速增长,在全球大卖了3.4亿美元。
罗氏的维博妥珠单抗全球销售情况

截图来源:药融云全球药物研发数据库
四、全球大卖!诺华「琥珀酸利柏西利片」国内获批上市
2023年1月29日,根据NMPA发布的药品批准证明文件送达信息显示,诺华公司申报的琥珀酸利柏西利片新药获批上市。用于治疗成人复发型多发性硬化,包括临床孤立综合征、复发-缓解型多发性硬化和活动性继发进展型多发性硬化。
公开资料显示,琥珀酸利柏西利片是一种选择性细胞周期蛋白依赖性激酶抑制剂,通过抑制细胞周期蛋白依赖性激酶4和激酶6(CDK4/6)这两种蛋白,帮助减缓癌症进展。当这些蛋白过度激活时,可加快癌细胞生长和分裂。琥珀酸利柏西利片能够以更高的特异性抑制CDK4/6,阻止癌细胞不受控制的继续增殖。
琥珀酸利柏西利片(Ribociclib)于2017年3月首次获FDA批准上市,是全球第2款新药获批上市的CDK4/6抑制剂。截止目前获FDA批准的适应症包括:
与芳香化酶抑制剂联合,用于绝经前/围绝经期以及绝经后激素受体(HR)阳性、HER2阴性晚期或转移性女性乳腺癌患者;
联合芳香酶抑制剂用于绝经前、围绝经期或绝经后妇女的初始内分泌治疗;
与氟维司群联合作为绝经后妇女的一线或二线治疗。

截图来源:药融云全球药物研发数据库
截至目前,琥珀酸利柏西利片已在美国、欧盟等数十个国家和地区新药获批上市,用于多种乳腺癌适应症。2021年其全球销售额达到9.37亿美元。作为目前国内唯一获批晚期一线绝经前适应症的CDK4/6抑制剂,凯丽隆将为中国绝经前和围绝经期HR+/HER2-晚期乳腺癌患者提供一种新的治疗选择,并带来更长生存期和更优生活质量的希望。
五、国货崛起!首款国产带状疱疹疫苗获批上市
2023年1月31日,根据NMPA发布药品批准证明文件送达信息显示,国家药品监督管理局批准百克生物申报的带状疱疹减毒活疫苗上市,用于40岁以上人群防止带状疱疹感染。这也是首个新药获批上市的国产带状疱疹疫苗。
公开资料显示,百克生物的带状疱疹疫苗为注射剂,规格为复溶后每瓶0.5ml,每1次人用剂量为0.5ml,含水痘-带状疱疹活病毒应不低于4.3lgPFU。百克生物的带状疱疹疫苗为高病毒滴度减毒活疫苗产品,通过皮下注射进入到人体,带状疱疹减毒病毒被吞噬细胞识别并捕获,T细胞和B细胞形成免疫记忆,当带状疱疹病毒再次进入机体,能够被T、B细胞迅速识别,快速、大量产生效应细胞和抗体,消灭体内病毒,从而预防疾病的发生。
百克生物的带状疱疹减毒活疫苗也是全球首个正式获批适用于40岁及以上成人的带状疱疹减毒活疫苗,只需要打一针就可完成免疫。在此之前,全球范围内有两款带状疱疹疫苗新药获批上市,分别为默沙东的Zostavax和葛兰素史克的Shingrix。而在国内,仅有葛兰素史克的Shingrix“欣安立适”获批,该疫苗于2020年6月28日正式在中国上市销售。全程需要两针,适用于50岁以上人群。
据药融云数据库显示,除百克生物外,国内还有包括万泰生物、绿竹生物、长春祈健、长生生物等在内的10余家企业也在布局带状疱疹疫苗产品。目前在药审中心除迈科康生物、绿竹生物、怡道生物递交的新药临床申请还在审评审批中、雅立峰生物撤回申请、默克不被批准外,其他都已获批临床,进展最快的处于Ⅱ期临床阶段。
带状疱疹减毒活疫苗国内审批情况

截图来源:药融云中国药品审评数据库
此次百克生物的带状疱疹减毒活疫苗,成为国产同类首个新药获批上市产品。同时,随着国产带状疱疹疫苗上市,外资企业独霸市场局面就此终结,实属为国货骄傲。
想要获取《药融云全球在研新药与靶点月报》完整内容,关注药融云公众号(yrydata),后台回复“报告”关键词进行领取。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论