
分析监测新药/仿制药最新注册申报情况、获批临床品种全球上市及研发进展,和药物研究进展,解读热门/潜力靶点、疗法、适应症领域重大事件,追踪全球医药大健康投融资与发展动向......尽在《药融云医药行业观察周报》。
据《药融云医药行业观察周报》统计,在2023.01.23-2023.01.29期间,共有24个创新药/改良型新药注册申请获CDE承办(按受理号统计,不含补充申请)。其中,国产药品受理号21个,进口药品受理号3个。这期间,共计22款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药15款,生物药6款,中药1款。
获批临床创新药/改良型新药信息(部分)

图片来源:《药融云医药行业观察周报》
注:此处所列创新药/改良型新药,主要是指国家药品监督管理局药品审评中心(CDE)受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。想要获取更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过药融云数据库进行分析查询,和(或)关注药融云公众号(yrydata),后台回复“报告”关键词进行报告领取。
其中,值得注意的有:
1.ZLT-001注射液——抗癌新疗法
广州智瓴生物的ZLT-001注射液获得临床试验默示许可,拟用于治疗晚期复发或转移性宫颈癌。ZLT-001注射液是广州智瓴生物自主研发的第二代TIL细胞药物ZLT-001注射液,也是华南地区首个获批临床的肿瘤浸润淋巴细胞药物(TIL)。
ZLT-001注射液通过从患者的肿瘤组织内分离出肿瘤浸润淋巴细胞(TILs),经过智瓴生物独有的YoungTIL-Exp™技术平台,采用时间轴激活、靶向耦合化、TME抗扰等独特技术对TIL进行纯化,增强TIL的活性与对实体肿瘤杀伤能力,并将数量扩增到十亿甚至是百亿级以上,回输到患者体内实现快速、有效杀伤肿瘤细胞,控制肿瘤生长。
ZLT-001注射液获批临床-审评耗时87天

图片来源:药融云中国药品审评数据库
TIL免疫疗法,是一种新型细胞免疫疗法,可以说是免疫疗法赛道上一个异军突起的抗癌新疗法,也是个体化医疗技术和现代医学技术充分融合的一个典范。由TIL疗法引申研发出的抗体将会被制成广谱药物,将来癌症患者不仅可以依靠激发自身的免疫力,还可以依靠这些合成抗体,一起与癌细胞作斗争,可为癌症患者带来更多的治疗选择。
近几年,关于TIL疗法的研究数量持续增长,布局该领域的企业也逐渐增加。据药融云医药投融资数据库显示,国内有多家布局TIL疗法的企业获得融资,包括原启生物、循生生物、森朗生物、天科雅、劲风生物、毕诺济生物等。除此之外,还有沙砾生物、华赛伯曼、西比曼生物、君赛生物、厚无生物等国内企业布局TIL疗法。
一键查询TIL疗法布局企业投融资数据
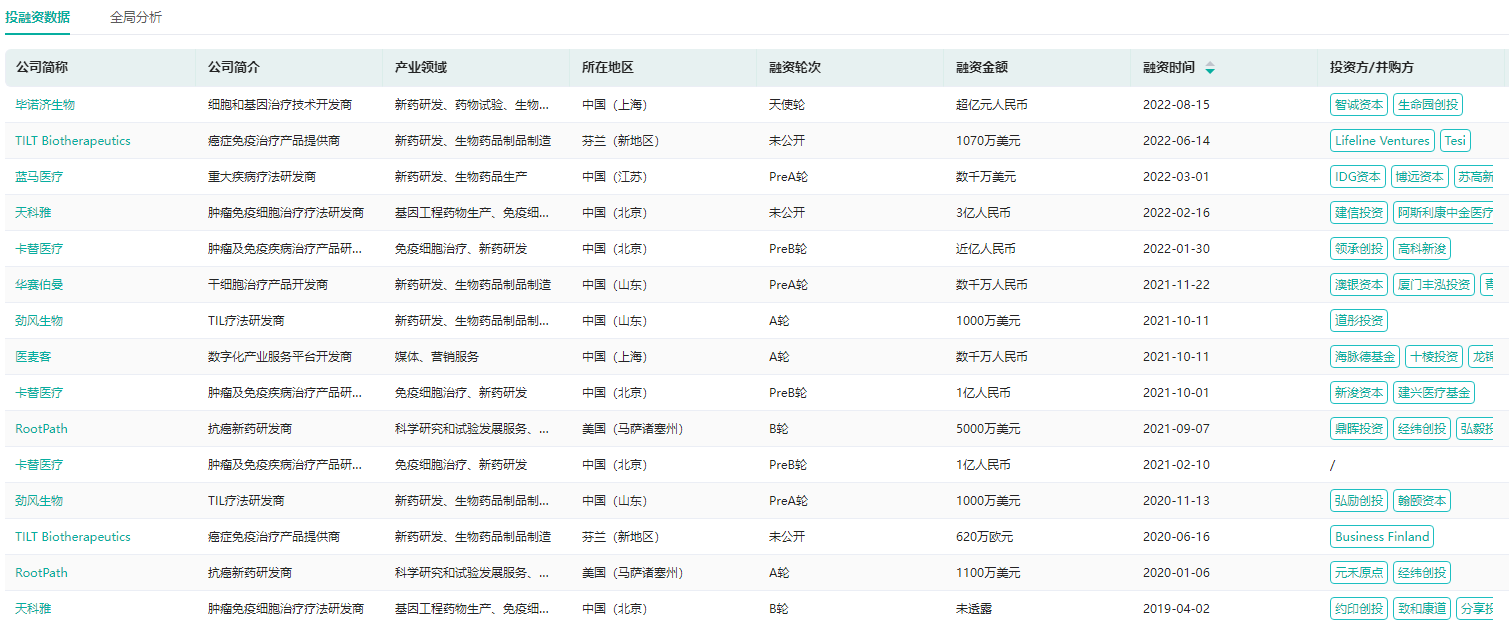
图片来源:药融云医药投融资数据库
据药融云中国临床试验数据库显示,目前,国内多款TIL疗法获批进入临床试验阶段,这意味着国内TIL疗法将逐步驶入快车道,想必随着更多临床数据的发布及其产品的上市,国内TIL疗法将会进入高速发展阶段。
TIL疗法临床试验申办企业情况
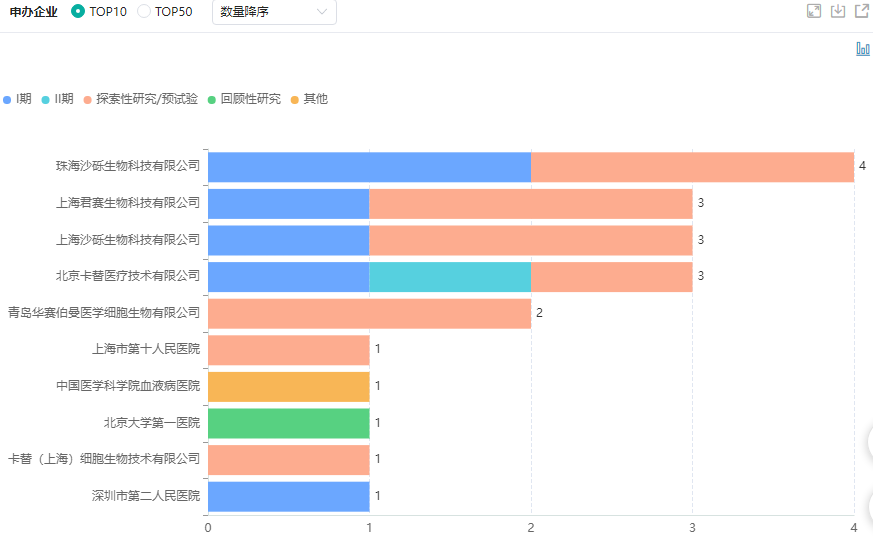
图片来源:药融云中国临床试验数据库
2.注射用BB-1709——创新ADC
百力司康生物的注射用BB-1709获得临床试验默示许可,拟用于治疗CD73表达的局部晚期/转移性实体瘤。注射用BB-1709是一款First-in-Class创新型免疫抑制靶点的ADC,拥有广泛的实体瘤适应症,已于2022年10月在美国获得FDAI期临床试验许可。
药融云全球药物研发数据库显示,目前百力司康已有三款创新ADC(BB-1701、BB-1705、BB-1709)处于临床阶段。BB-1701为一款HER2抗体偶联物(antibody-drugconjugate,ADC),目前正在推进II期临床队列扩展研究;BB-1705为EGFRADC,与BB-1701一样拥有相同的独特的上市药毒素艾立布林(Eribulin),正在进行I期临床研究。
百力司康研发管线查询

图片来源:药融云全球药物研发数据库
3.SAL0119片——口服小分子免疫抑制剂
信立泰1类新药SAL0119片获批临床,适应症为活动性强直性脊柱炎(AS)及中重度活动性类风湿关节炎(RA)。强直性脊柱炎(AS)和类风湿关节炎(RA)均属于自身免疫疾病,目前该疾病的发病原因尚不完全明确,且无法治愈。
SAL0119是一款口服小分子免疫抑制剂,具有独特的不同于JAK类的作用机制和广谱的细胞因子抑制作用,临床前研究数据体现出良好的有效性和安全性。若能研发成功并获批上市,将为AS、RA患者提供新的用药选择,满足未被满足的临床需求。
药融云数据库显示,目前信立泰主要在研创新药有21款,以肿瘤、心脑血管领域为核心,延伸到内分泌与代谢、神经系统、血液系统、免疫调节等领域。其中,恩那司他、SAL-0107已提交NDA申请,SAL-0108、SAL-056、S-086、FCN-005已处于Ⅲ期临床阶段。
信立泰在研创新药(部分)

图片来源:药融云全球药物研发数据库
4.普特利单抗注射液——PD-1单抗
乐普生物的PD-1抑制剂普特利单抗注射液获批临床,拟开展治疗非肌层浸润性膀胱癌患者的研究。2022年7月,普特利单抗注射液于在中国获批上市,成为国内第10款PD-1单抗,适用于不可切除或转移性的MSI-H或dMMR的晚期实体瘤患者。同年9月,其新适应症获批,用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤。
药融云数据库显示,目前除了已批准的适应症,普特利单抗注射液在研适应症还有:转移性胃癌、转移性乳腺癌、转移性结直肠癌、肝细胞癌、膀胱癌、转移性非小细胞肺癌、黑色素癌、软组织肉瘤。
普特利单抗注射液基本信息查询
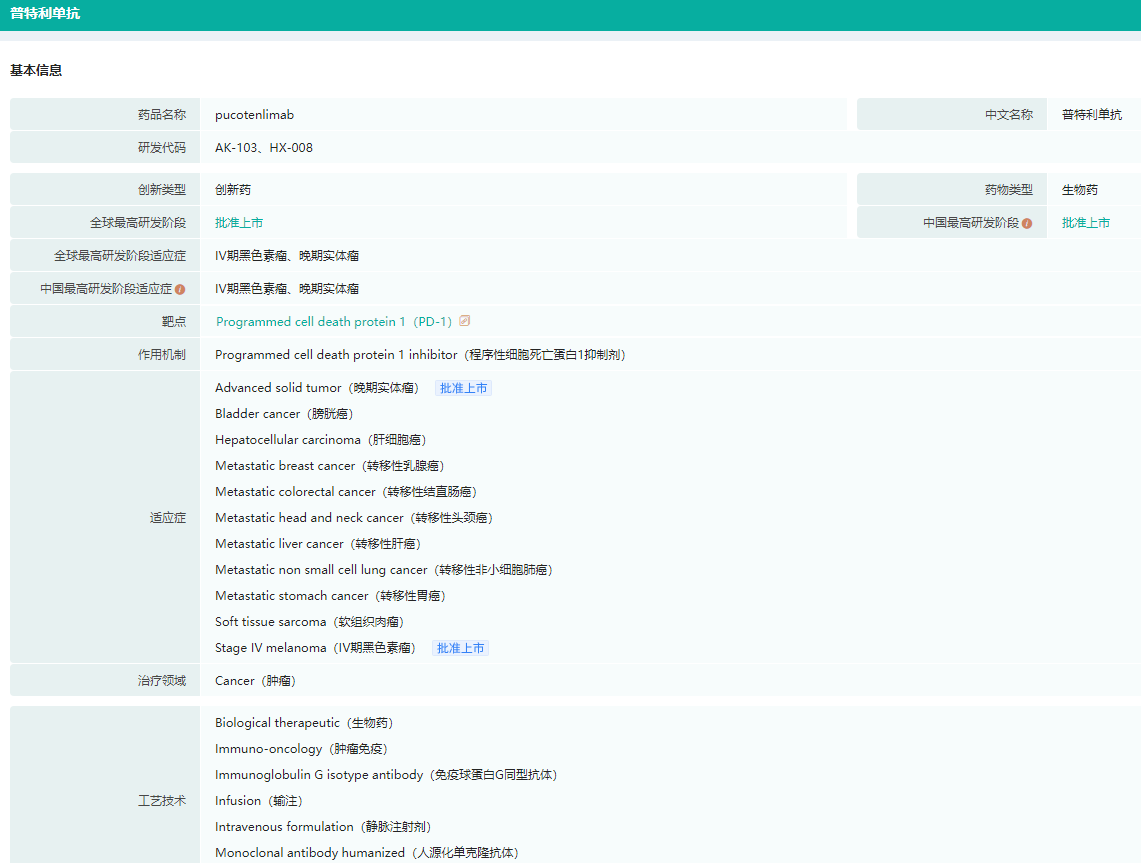
图片来源:药融云全球药物研发数据库
5.甲磺酸贝福替尼胶囊——第三代EGFR-TKI
贝达药业的甲磺酸贝福替尼胶囊,拟用于“EGFR敏感突变阳性的IB-IIIB(T3N2M0)期非小细胞肺癌术后辅助治疗”适应症获批开展临床试验。甲磺酸贝福替尼胶囊是第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),其NSCLC一线、二线治疗适应症目前均在NDA审评过程中,此次是贝福替尼开展的第三项适应症研究。
订阅“甲磺酸贝福替尼胶囊”,实时监测审评进度
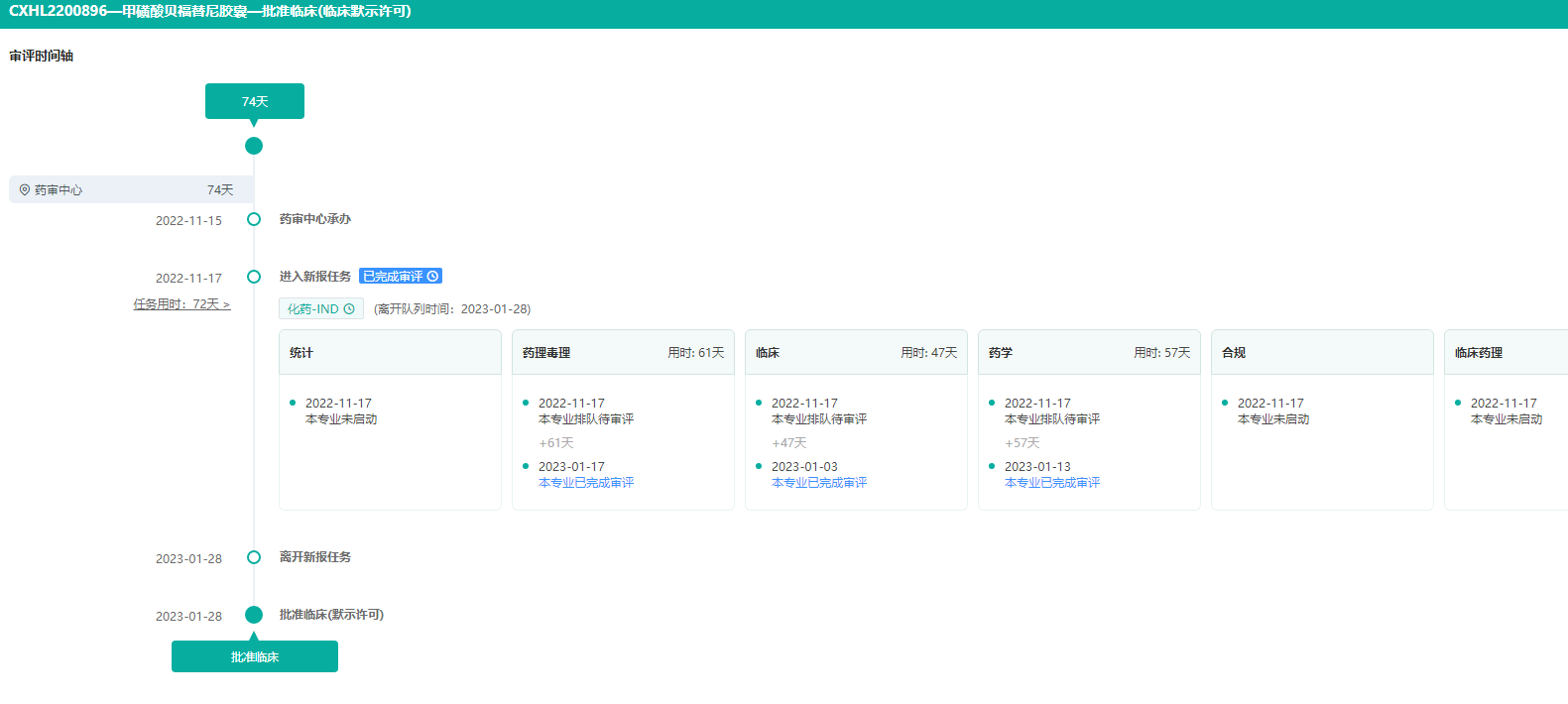
图片来源:药融云中国药品审评数据库
甲磺酸贝福替尼是贝达药业与益方生物协作开发的项目,该药也是继盐酸埃克替尼(第一代EGFR-TKI)、盐酸恩沙替尼(ALK靶点)、贝伐珠单抗(MIL60)后,贝达药业第4个申请上市的新药。
另外,还有一款获批上市的创新药,即诺华制药的琥珀酸利柏西利片。
6.琥珀酸利柏西利片——CDK4/6抑制剂
琥珀酸利柏西利片(商品名:凯丽隆)是一种选择性细胞周期蛋白依赖性激酶抑制剂,通过抑制细胞周期蛋白依赖性激酶4和激酶6(CDK4/6)这两种蛋白,帮助减缓癌症进展。当这些蛋白过度激活时,可加快癌细胞生长和分裂。琥珀酸利柏西利片能够以更高的特异性抑制CDK4/6,阻止癌细胞不受控制的继续增殖。
作为目前国内唯一获批晚期一线绝经前适应症的CDK4/6抑制剂,凯丽隆将为中国绝经前和围绝经期HR+/HER2-晚期乳腺癌患者提供一种新的治疗选择,并带来更长生存期和更优生活质量的希望。
琥珀酸利柏西利片获批进口,审评耗时464天
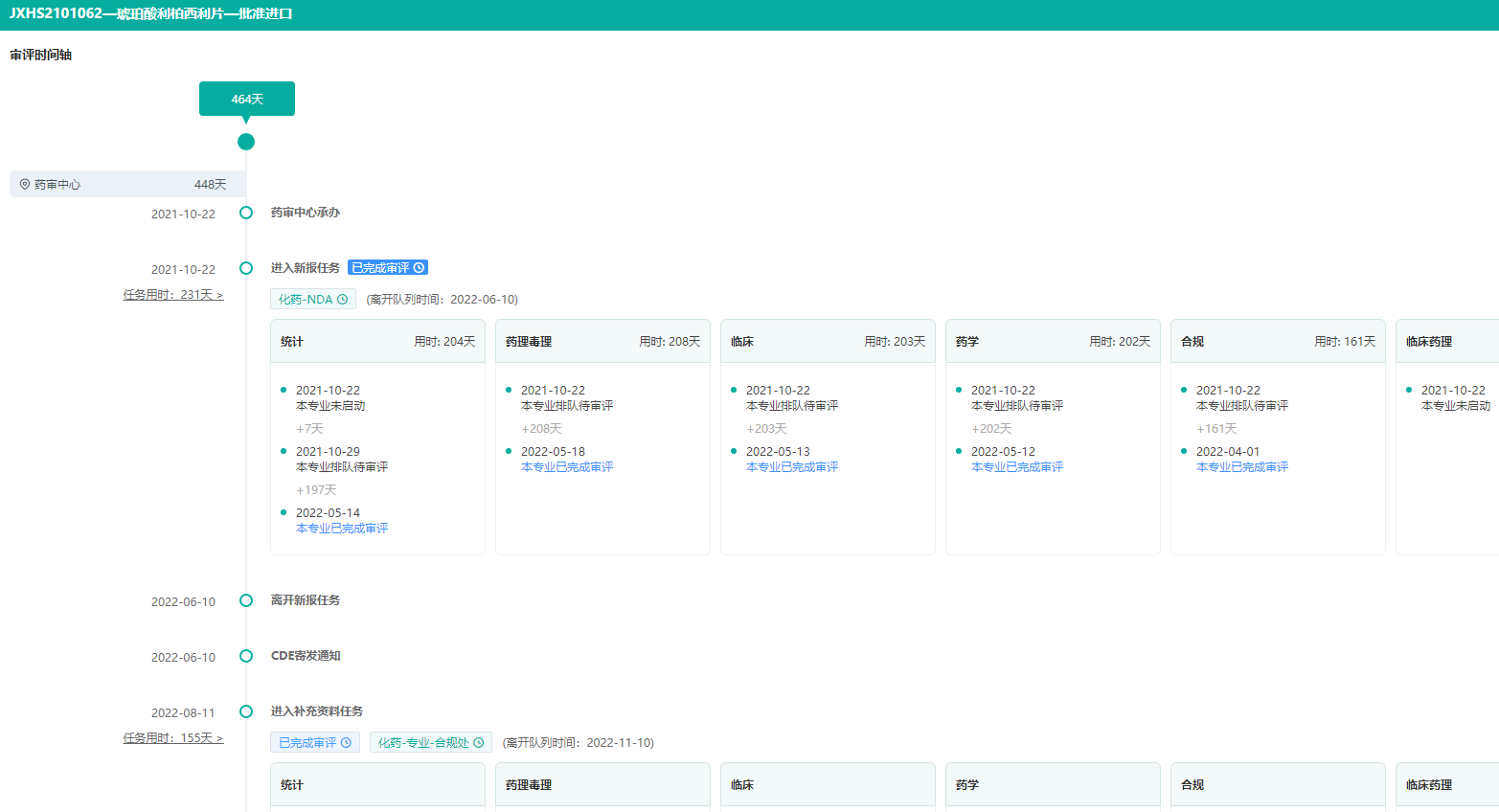
图片来源:药融云中国药品审评数据库
琥珀酸利柏西利片,于2017年3月首次获FDA批准上市,与芳香化酶抑制剂联合,用于绝经前/围绝经期以及绝经后激素受体(HR)阳性、HER2阴性晚期或转移性女性乳腺癌患者。同时,也是全球第2款获批上市的CDK4/6抑制剂。
此后,琥珀酸利柏西利片又被批准联合芳香酶抑制剂用于绝经前、围绝经期或绝经后妇女的初始内分泌治疗,以及与氟维司群联合作为绝经后妇女的一线或二线治疗。截至目前,琥珀酸利柏西利片已在美国、欧盟等数十个国家和地区获批上市,用于多种乳腺癌适应症。
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论