根据药融云数据库显示。2021年8月,美国FDA共批准:
- 5款创新药,包含2个新分子实体和3个生物药。其中Skytrofa、Korsuva、Welireg、Nexviazyme这四款药物为全球首次获批上市。
- 5款改良型新药
- 59款仿制药,其中5个仿制药为暂定批准。中国药企获6个ANDA批文,涉及东阳光、齐鲁、人福医药、健友等企业。
8月FDA批准的创新药

(数据来源:药融云数据库)
8月FDA批准的改良型新药

(数据来源:药融云数据库)
8月中国药企获批的ANDA批文
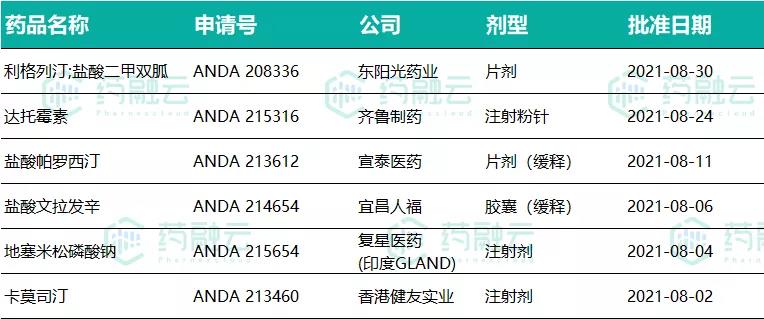
(数据来源:药融云数据库)
一、lonapegsomatropin首个儿童生长激素缺乏症每周疗法
8月25日,美国FDA批准Ascendis Pharma 的新药Skytrofa (lonapegsomatropin) 用于治疗因内源性生长激素(GH)分泌不足而导致生长障碍的1岁及以上儿童患者。每周注射一次Skytrofa成为FDA批准的首个持续1周释放生长激素的产品。
该批准代表GHD儿童及其家庭可以选择每周一次的生长激素疗法,在关键的头对头临床试验中,每周一次SKYTROFA在第52周的年化身高增长速度高于生长激素,”主要研究者、儿科内分泌专家Paul Thornton在Ascendis Pharma发布的文章中说道。“这种每周一次的治疗可以减轻治疗负担,并有可能取代 30 多年来一直是治疗标准的每日生长激素疗法。”

来源:药融云全球药物研发数据库
二、Difelikefalin首个治疗CKD相关性瘙痒药物
8月23日,美国FDA批准Cara Therapeutics公司新药Korsuva (Difelikefalin)上市,用于治疗慢性肾脏疾病相关性瘙痒(CKD-aP),Difelikefalin是首个治疗血液透析患者中重度瘙痒的药物。
difelikefalin(CR845)也是首个(first-in-class)KOR激动剂,对人体外周神经系统和某些免疫细胞具有调节作用。Difelikefalin在解决严重皮肤瘙痒,预防感染方面有着重大优势。
慢性肾脏疾病相关性瘙痒(CKD-aP)是一种难治性全身瘙痒,在接受血液透析的慢性肾病(CKD)患者中发生频率高、强度大,在III-V期CKD患者中也有未接受透析而发生瘙痒的现象。中重度慢性瘙痒会直接降低患者生活质量,CKD-aP也是血液透析患者死亡率的独立预测因子,主要与炎症和感染风险增加有关。
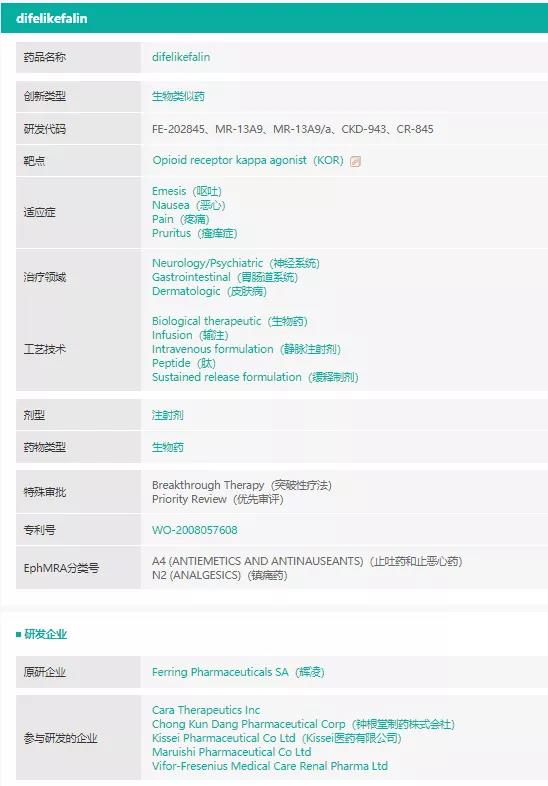
来源:药融云全球药物研发数据库
三、Dostarlimab第二个不限癌种的PD-1单抗
8月17日,美国(FDA)加速批准了葛兰素史克的Jemperli(Dostarlimab)上市,用于错配修复缺陷复发 (dMMR) 复发或晚期实体瘤成人患者,这些患者在既往的治疗方案中疾病进展,没有其他满意的可选择方案。这意味着又一款不限癌种的新药加入广谱抗癌的队列,成为第二个不限癌种的PD-1单抗,将给晚期实体瘤患者带来更多的选择和希望。
这是dostarlimab今年获批的第二个适应症,早在 2021 年 4 月,FDA 已加速批准 dostarlimab 用于治疗 dMMR 复发或晚期子宫内膜癌的成年患者。

来源:药融云全球药物研发数据库
四款FDA批准的不限癌种药物
- 2017年5月,Keytruda(PD-1)成为全球首个不区分肿瘤来源的免疫药物;
- 2018年11月,Vitrakvi获批上市,成为全球首款不限癌种的广谱靶向药,用于NTRK融合的实体瘤患者;
- 2019年8月,Rozlytrek获批上市,成为全球第三款不区分肿瘤来源的广谱抗癌药;
- 2020年5月,传奇抗癌药LOXO-292加速获批上市,用于治疗晚期RET融合阳性非小细胞肺癌、RET突变型甲状腺髓样癌(MTC)和RET融合阳性甲状腺癌三大癌种。
四、Belzutifan首个VHL相关肿瘤全身治疗药物
8月 13日,美国FDA批准默克新药Welireg(Belzutifan)上市,用于治疗与von Hippel-Lindau (希佩尔-林道综合征,VHL)疾病相关的癌症患者,这些患者不需要立即手术但是需要进行相关的癌症治疗,包括:肾细胞癌(RCC)、中枢神经系统(CNS)血管母细胞瘤、胰腺神经内分泌肿瘤(pNETs)。迄今为止,Belzutifan是唯一获批的VHL相关肿瘤全身治疗药物。
Belzutifan是一种新型、选择性小分子缺氧诱导因子2α(HIF-2α)抑制剂。当肿瘤抑制蛋白VHL失活时,HIF-2α蛋白在癌细胞内积累,发出缺氧这一错误信号,激活血管的形成,刺激肿瘤的生长。
希佩尔-林道综合征(VHL)是一种罕见的常染色体显性遗传性疾病,37.2%的VHL患者表现为血管瘤,且通常累及视网膜,由此产生的失明十分常见。我国患者外显率高,60岁时外显率高达97%。目前,尚无治愈VHL的方法。

来源:药融云全球药物研发数据库
Avalglucosidase alfa新一代庞贝病疗法
8月6日,美国FDA批准Genzyme Corp 新药Nexviazyme(Avalglucosidase alfa)上市,用于治疗II型糖原贮积症(庞贝病)。
庞贝病是一种罕见的退行性肌肉疾病,会影响个体的移动和呼吸能力。它是由于溶酶体中的酸性α-葡萄糖苷酶(GAA)的遗传缺陷或功能障碍引起的,导致全身肌肉细胞中糖原的积累,最终导致肌肉的不可逆损伤,包括支持肺功能的呼吸肌和膈肌,以及影响活动能力的其他骨骼肌。
Avalglucosidase alfa是一种在研酶替代疗法,旨在改善GAA向肌肉细胞的递送。为了减少糖原积累,GAA必须被递送到肌肉细胞内的溶酶体中。与标准治疗α-葡萄糖苷酶相比,avalglucosidase alfa的M6P含量增加约15倍,旨在帮助改善细胞对酶的摄取并增强目标糖原清除。此处获批为这类患者提供一种新标准治疗。

来源:药融云全球药物研发数据库











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论