

18983288589(微信同号)

18983288589(微信同号)

18908392210(微信同号)

18980413049


2023-12-11
/
其他
江西省
征求意见稿或草案
/
江西省药监局
第一章 总则
第一条 为实施药品安全量化分级分类管理,规范药品批发(连锁)企业经营行为,促进我省医药产业有序发展,根据《中华人民共和国药品管理法》及其实施条例、《药品经营和使用质量监督管理办法》及《药品经营质量管理规范》等规定,结合我省实际,制定本办法。
第二条 本办法适用于省内药品批发(连锁)企业(以下简称“企业”)。
第三条 本办法中的量化分级分类监管,是指省药品监督管理局(以下简称“省局”)根据企业《药品经营许可证》经营范围、责任意识、监管情况、社会影响等因素,对其量化分级、分类,并实施监管的方式。
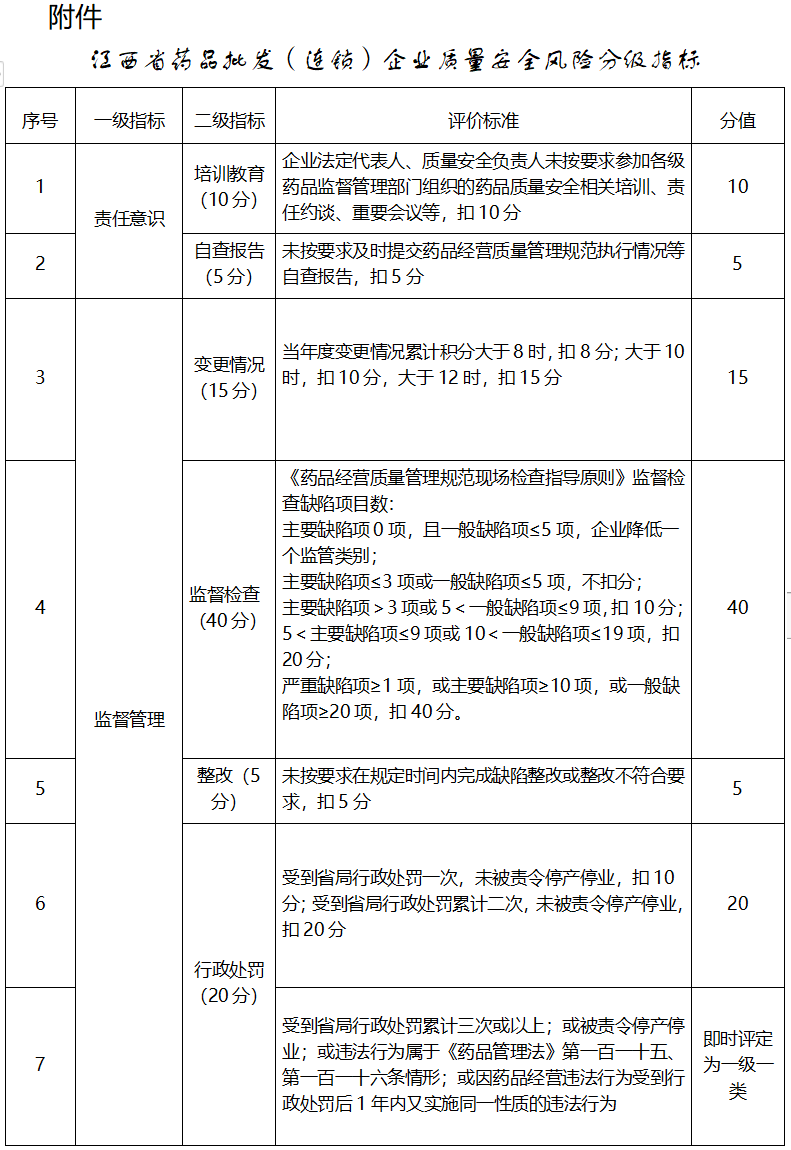
第四条 省局负责制定本办法,对企业开展质量安全风险等级划分,制定《江西省药品批发(连锁)企业质量安全风险分级指标》(见附件),设置责任意识、监督管理、社会影响等三个一级指标,一级指标下设若干二级指标,根据监管实际可以适时调整。
省局根据企业经营范围及附件指标确定企业的监管级别和类别,组织实施监督管理工作。药品检查员中心、樟树药监局根据监管职能,及时归集相关基础数据,于每年12月25日前汇总至省局药品经营监管处。
第二章 分级、分类、量化
第五条 按照企业《药品经营许可证》经营范围由高到低分为三个监管级别:
一级监管是指:企业《药品经营许可证》经营范围中含有麻醉药品、第一、二类精神药品、药品类易制毒化学品、医疗用毒性药品、中药饮片(含毒性)、细胞治疗类血液制品、罂粟壳及疫苗储存配送企业;
二级监管是指:企业《药品经营许可证》经营范围中含有生物制品(含冷藏冷冻药品)、血液制品、蛋白同化制剂、肽类激素、体外诊断试剂(药品);
三级监管是指:企业《药品经营许可证》经营范围中含有中药饮片、中成药、化学药;
企业经营范围涉及多个监管级别的,按最高级别对其监管。企业变更经营范围的,按经营范围重新划定监管等级,但监管类别不变。
第六条 每一监管级别,从高到低分为三个监管类别。
一类监管企业,为重点监管对象;
二类监管企业,为主要监管对象;
三类监管企业,为一般监管对象。
各企业初始监管等级为第三类。
第七条 企业《药品经营许可证》频繁变更,视为存在质量风险。省局按变更频次和项目量化分值,累计评分(变更项分值详见表格)并在省局网站公示。
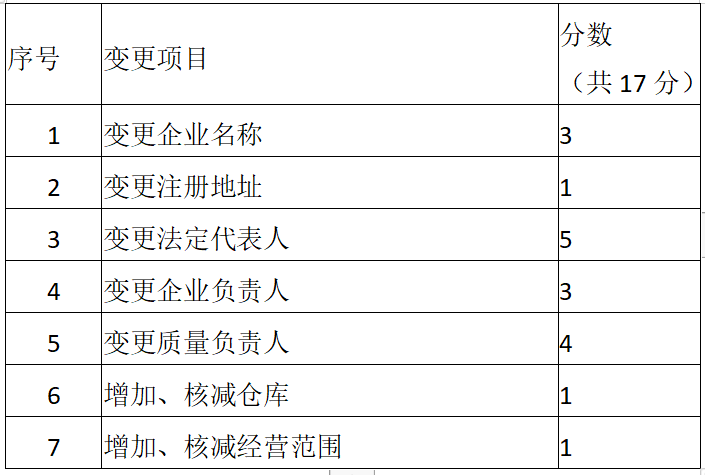
一次变更多个项目的,需累计分值。
第八条 企业质量安全风险分级每年评定一次。以当年度12月25日起往前追溯一年为一个评定年度。在评定年度5月31日后取得药品经营许可证的企业,不参加当年度评定,在此期间的评定信息计入下一评定年度。
企业质量安全风险分级评定根据本办法附件规定的分级指标开展,分为自评、信息核对、初评、结果告知和异议申请、异议处理和终评五个阶段。
(一)自评。企业应当于每年12月1日至12月25日期间提交自评信息并附真实性承诺。
(二)信息核对。省局经营处组织有关处室、直属单位于每年12月30日前集中核对企业自评信息。
(三)初评。省药监局于次年1月15日前形成初评分级结果。
(四)结果告知和异议申请。检查员中心各检查所、樟树药监局应当在次年1月20日前将初评分级结果告知企业,企业对分级结果有异议的,应当在收到告知结果后的7个工作日内向省药监局提出异议申请,并提供相应说明和证据材料。
(五)异议处理和终评。省药监局经营处应当在收到企业异议申请后的7个工作日内组织复核,并作出维持或调整分级结果的终评结论。
省药品检查员中心各检查所、樟树药监局应当在评定后5个工作日内将分级结果告知企业,有关异议申请、处理等按照前款规定办理。
第九条 企业质量安全风险分级所依据的行政处罚或者其他行政处理决定被撤销、确认违法或者无效,可能影响到分级结果的,企业可以向省药监局提出申请,省药监局应当依据本办法予以相应调整。
第十条 省药监局有关处室和直属单位应当加强对药品经营质量安全风险分级结果的综合运用,合理确定监管重点、监管措施和监管频次等。
企业年度质量安全风险分级积分初值为100分,每一年度内,企业积分降至80分时,在企业本年度及下一年度提高一个监管级别;降至60分至80分(不含)时,省局对企业负责人或法定代表人进行约谈,同时对企业本年度及下一年度提高一个监管类别和一个监管级别;低于60分时,该企业连续三年应被列为一级一类监管企业。
第十一条 省局依据上述原则实施量化分级分类动态监管,并及时公布相关信息。
第三章 监管措施
第十二条 省局有关处室、直属单位应当根据药品经营质量安全风险分级结果合理确定、动态调整常规检查频次,实施差异化分级监管,制定全省监督检查计划。
第十三条 检查员中心、樟树药监局对企业按量化分级、分类信息,采取飞行检查、专项检查和日常检查、企业自查等多种手段强化监管。
检查员中心将对一级监管企业,每年不少于一次的监督检查;二级监管企业,对其每两年不少于一次的监督检查;三级监管企业,对其每三年不少于一次的监督检查。
一类监管企业将采取飞行检查的模式进行监管,二类监管企业将采取专项检查的模式进行监管,三类监管企业将采取日常检查或企业自查的模式进行监管。
第十四条 企业处于歇业状态的,应及时主动报告,省局对企业状态予以公开。
第十五条 检查员中心应配合省级药品监督管理部门建立企业监管档案。监管档案应包括附件1列出的企业各类质量安全风险指标信息。
第四章 附则
第十六条 飞行检查是指根据监管工作需要,对企业开展的突击性检查。
专项检查是指对企业开展有侧重的单项监督检查。
企业自查是指企业按照《药品经营质量管理规范》要求进行自我检查的一种形式。
歇业是指企业法人领取《企业法人营业执照》后,满六个月尚未开展经营活动或者停止经营活动满一年的企业。
企业歇业应向省局提交备案报告。歇业期间,不得开展药品经营活动。如企业在许可证有效期内恢复经营,须向省局提出恢复营业申请。省局按照《药品经营和使用质量监督管理办法》及《药品经营质量管理规范现场检查指导原则》进行检查,检查合格的省局发还《药品经营许可证》后,方可恢复药品经营活动。
第十七条 本办法自发布之日起施行。


摩熵医药2025-01-08

摩熵医药2024-12-17
Pharma CMC2024-10-15
摩熵医药(原药融云)2024-08-21
数屿医械2024-06-24
数屿医械2024-06-13
数屿医械2024-05-30
摩熵医药(原药融云)2024-05-27
药事纵横2024-02-28
药通社2023-12-26
2025-01-14
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-07
2025-01-07
2025-01-06
2023-12-11
2022-09-06
2025-01-08
2024-12-16
2024-10-22
2024-07-30
2024-07-29
2024-06-27
2024-05-30
2024-05-30
2024-05-29
2024-05-29
2024-05-10
2024-04-29
2024-04-25
2024-04-12
2024-04-12