

18983288589(微信同号)

18983288589(微信同号)

18908392210(微信同号)

18980413049


2024-02-26
/
其他
江西省
征求意见稿或草案
/
江西省药品监督管理局
江西省核发《放射性药品使用许可证》验收标准(征求意见稿)
一、根据《中华人民共和国药品管理法》及其实施条例、《放射性药品管理办法》《关于开展换发<放射性药品使用许可证>工作的通知》(国食药监安〔2003〕199号)等有关规定,制订本标准。
二、许可证类别及药品使用范围
(一)第一类:使用体外诊断用各种含放射性核素的分析药盒。
(二)第二类:
1.体内诊断、治疗用一般放射性药品(系指根据诊断、治疗需要,对购入的放射性药品进行简单的稀释或不稀释用于病人的品种。如碘[131I]化钠口服溶液、邻碘[131I]马尿酸钠注射液、氯化亚铊[201T1]注射液等);
2.即时标记放射性药品生产企业提供的已配制完成的含锝[99mTc]注射液。
(三)第三类:
1.《放射性药品使用许可证》(第二类)规定的放射性药品;
2.采用放射性核素发生器及配套药盒自行配制的体内诊断及治疗用放射性药品;
3.采用市售自动合成装置自行制备的正电子类放射性药品。
(四)第四类:
1.《放射性药品使用许可证》(第三类)规定的放射性药品;
2.F18标记的FAPI、PSMA;Ga68标记FAPI、PSMA;Lu177标记的PSMA;
3.可研制和使用放射性新制剂以适应核医学诊治新方法、新技术的应用。研制范围仅限国内市场没有或技术条件限制而不能供应的品种。
注:《放射性药品使用许可证》(第四类)分为四类证(仅限使用)和四类证(研制和使用),其中四类证(仅限使用)适用以上第1、第2种情况,四类证(研制和使用)适用以上第1、第2、第3种情况。
三、结果评定
本标准设评定条款一类共九项29条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款17条。二类共九项28条,其中设否决条款2条(条款号前加“**”);重点条款10条(条款号前加“*”);一般条款16条。三类共九项69条,其中设否决条款7条(条款号前加“**”);重点条款21条(条款号前加“*”);一般条款41条。四类(仅限使用)共九项72条,其中设否决条款7条(条款号前加“**”);重点条款22条(条款号前加“*”);一般条款43条。四类(研制和使用)共九项74条,其中设否决条款7条(条款号前加“**”);重点条款23条(条款号前加“*”);一般条款44条。标记“☆”仅限正电子类放射性药品,未标记的适用后面注明的类别。缺陷项目数量与结果判定如下:
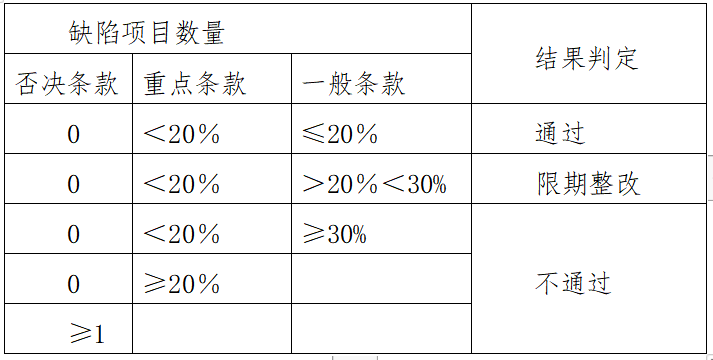
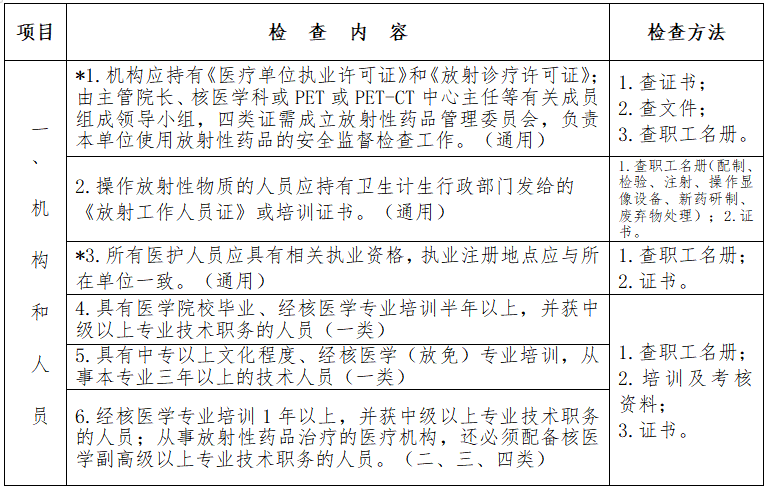
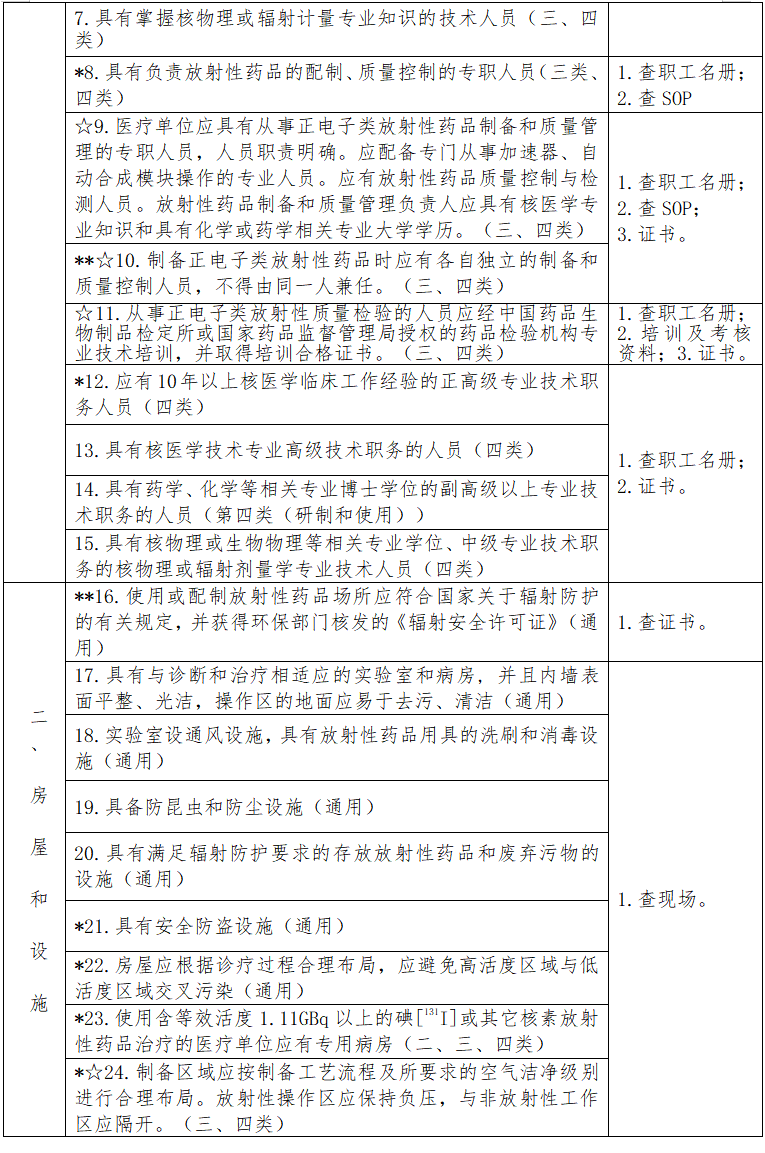
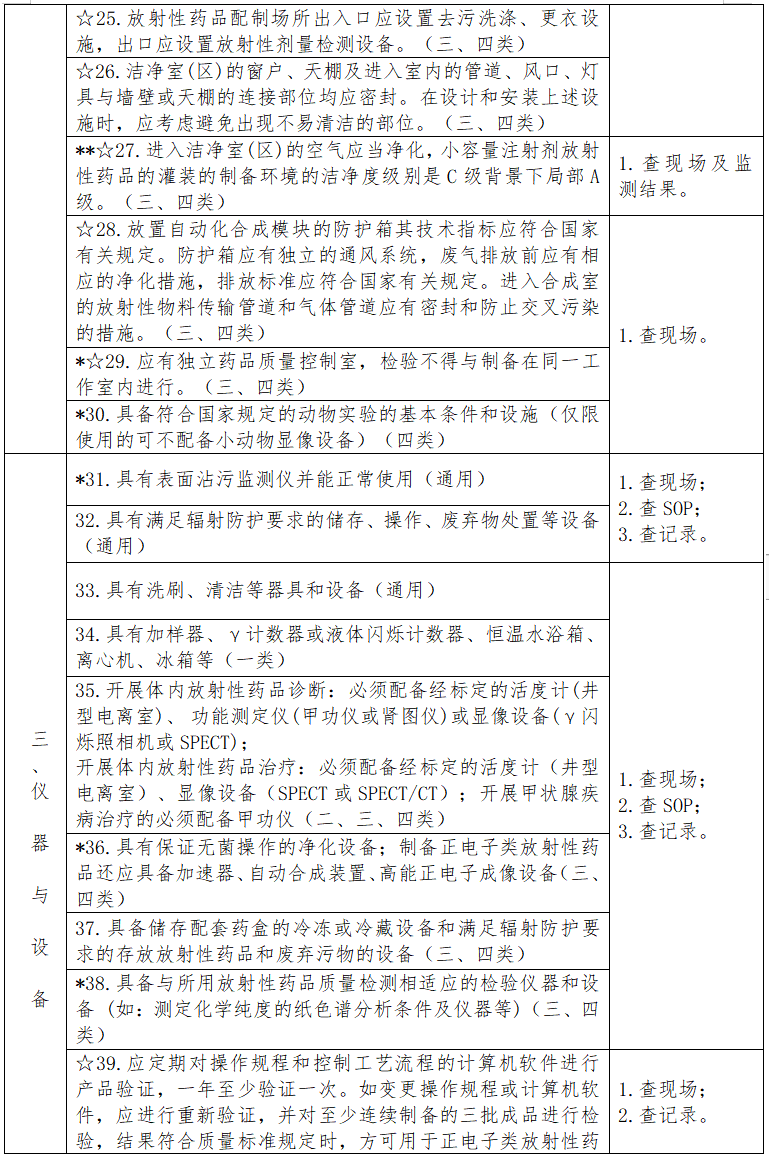
四、评定内容
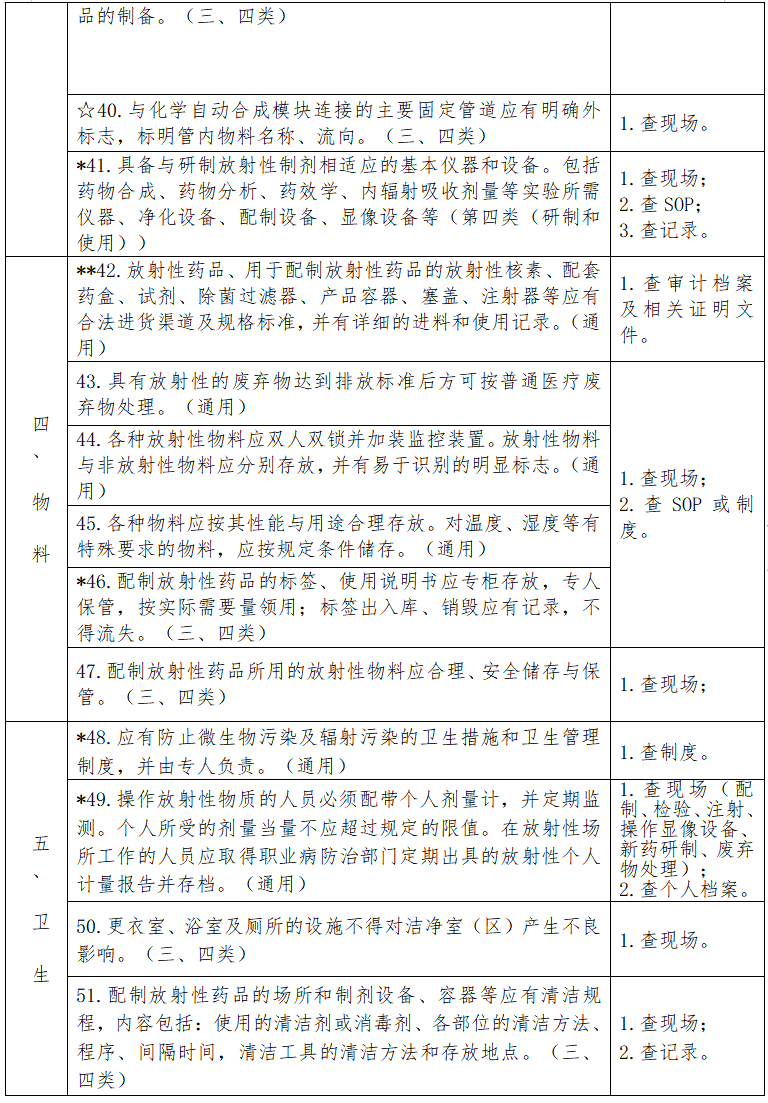
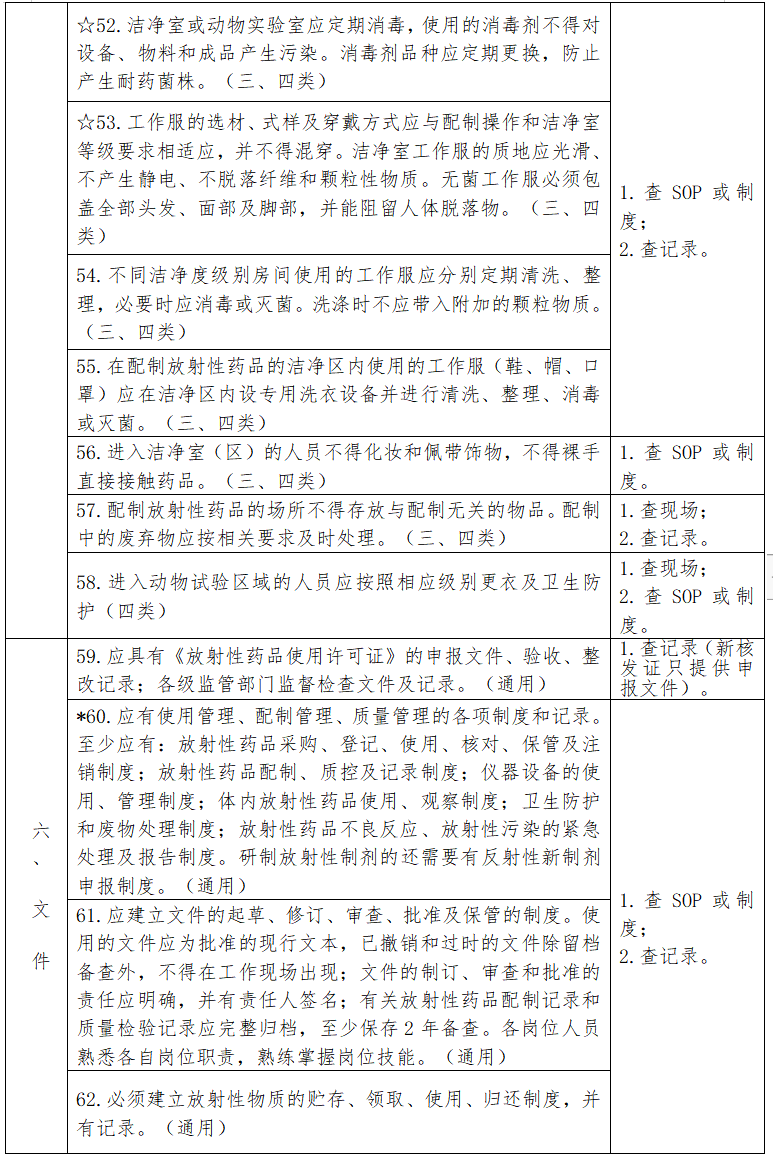
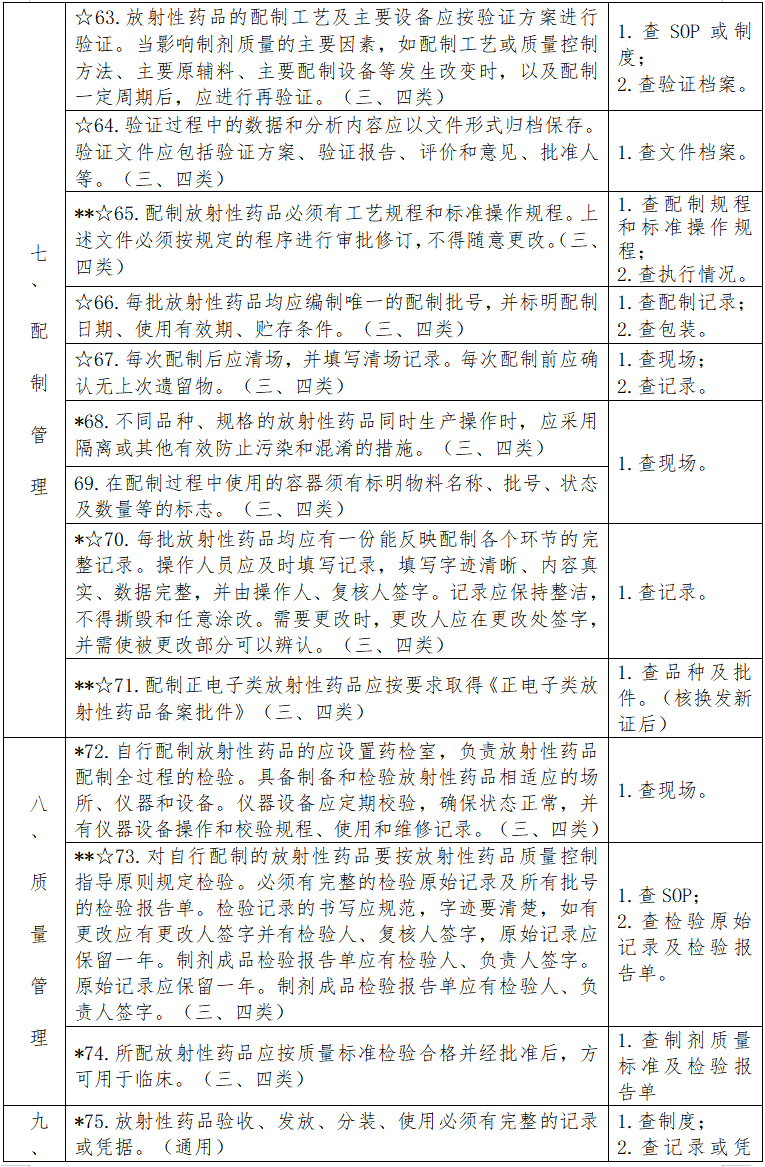
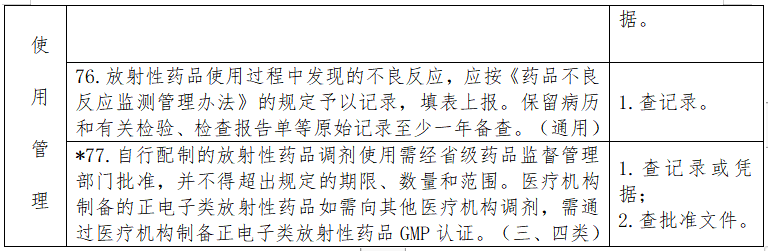
见下表。

摩熵医药2025-01-08

摩熵医药2024-12-17
Pharma CMC2024-10-15
摩熵医药(原药融云)2024-08-21
数屿医械2024-06-24
数屿医械2024-06-13
数屿医械2024-05-30
摩熵医药(原药融云)2024-05-27
药事纵横2024-02-28
药通社2023-12-26
2025-01-14
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-07
2025-01-07
2025-01-06
2024-06-27
2024-05-29
2024-05-29
2024-04-25
2024-04-12
2024-02-26
2024-01-26
2023-10-20
2023-09-20
2023-02-06
2022-11-18
2022-10-14
2025-01-08
2024-12-16
2024-10-22
2024-07-30
2024-07-29
2024-06-27
2024-05-30
2024-05-30
2024-05-29
2024-05-29
2024-05-10
2024-04-29
2024-04-25
2024-04-12
2024-04-12