

18983288589(微信同号)

18983288589(微信同号)

18908392210(微信同号)

18980413049


2024-06-04
/
其他
北京市
征求意见稿或草案
/
北京市药品监督管理局
关于临床急需进口药械和罕见病药品
追溯体系建设的指导意见
为进一步服务国家服务业扩大开放综合示范区和中国(北京)自由贸易试验区(以下简称“两区”)建设,贯彻落实《支持北京深化国家服务业扩大开放综合示范区建设工作方案》《北京市支持创新医药高质量发展若干措施(2024年)》等文件,切实保护人民群众用药安全,现就建立临床急需进口药械和罕见病药品追溯体系提出如下指导意见。
一、总体要求
(一)指导思想
以习近平新时代中国特色社会主义思想为指导,全面贯彻落实党的二十大精神,立足首都城市战略定位,服务国家重大战略,按照市委、市政府、市“两区”建设领导小组工作部署,积极推动建立临床急需进口药械和罕见病药品全过程追溯管理制度,实现药品和医疗器械来源可溯、去向可追、风险可控、责任可究。
(二)基本原则
政府主导。加强统筹规划,与本市“三医联动”工作机制和数据底座建设保持同步;组织各方积极参与,共同推动追溯体系建设;完善追溯标准,建立追溯平台;建立交换机制,强化互通共享,完善追溯链条。
全链覆盖。以产品流转为主线,以入境、流通、使用、销毁为节点,通过追溯平台及时准确记录、保存追溯数据,形成互联互通的追溯数据链,实现入境药械流通和使用全过程来源可溯、去向可追。
压实责任。有效落实监管部门、医药进口企业、使用单位等的主体责任,形成工作闭环;严防流弊事件发生;确保发生质量安全风险的药械可召回、责任可追究。
严管数据。开展相关工作应当严格按照法律法规要求做好数据安全及保密等管理工作。
二、工作目标
市药监局牵头,会同市卫生健康委、北京海关、首都机场临空经济区管委会、大兴机场临空经济区联合管委会、相关区政府等,建立临床急需进口药械和罕见病药品的全过程追溯管理制度,完善追溯系统,汇聚各类信息,压实企业、医疗卫生机构主体责任,实现全过程追溯。
三、工作要求
各相关方要高度重视追溯体系建设工作,抓紧部署,加快落实;从制度上、技术上保证药品追溯数据真实、准确、完整、不可篡改和可追溯。药品追溯数据记录和凭证保存期限应不少于五年。应明确专职部门及人员负责药品追溯数据管理,确保数据安全、防止数据泄露。
追溯平台要对临床急需进口药械和罕见病药品全生命周期的信息进行集中管理和监控,统一控制和调取以下环节的信息:入境赋码、产品入库、产品出库、医疗卫生机构使用(含产品拆零、患者使用、采购退回)、退货入库、产品召回、报废销毁。
四、任务安排
(一)市药监局负责建立临床急需进口药械和罕见病药品信息化追溯平台;建立统一的对接接口数据规范;依法依职责督促北京市辖区内医药进口企业落实主体责任、依法合规经营。
(二)市卫生健康委负责依法依职责督促北京市辖区内医疗卫生机构落实主体责任。
(三)北京海关、首都机场临空经济区管委会、大兴机场临空经济区联合管委会、相关区政府负责依法依职责在本行政区域内配合开展相关工作。
(四)医药进口企业按照“一物一码、物码同追”的原则建立信息化追溯系统,并与追溯平台对接,按要求上传相关信息。产品入境后,医药进口企业在保税区内为产品的最小销售单元赋追溯码,识别产品名称、生产企业、规格、批号、有效期等关键信息;对产品的进销存、收发货、采购退回、报废销毁、产品召回等信息进行标识和记录;对委托配送的第三方物流企业提供的信息(如:物流单号、温控数据等)进行标识和记录;对产品报废销毁信息进行标识和记录(如:危险废物转移联单和销毁记录表等)。
(五)医疗卫生机构应当如实记录本单位临床急需进口药械和罕见病药品的出入库、产品拆零、患者使用、跟踪随访、采购退回等相关信息;配合产品召回相关工作;按要求向追溯平台上传相关数据,包括但不限于:医疗卫生机构名称、患者编号或就诊卡号、就诊时间、产品名称、批号、数量。
(六)信息技术企业、行业组织等单位可作为第三方技术机构,提供信息化追溯专业服务。
五、保障措施
(一)建立完善追溯体系建设协调推进工作机制。市药监局会同有关部门建立联席会议制度,加强协调配合,推动工作落实。
(二)将追溯体系建设与构建社会诚信机制、强化企业主体责任、问题产品召回紧密结合,最大限度发挥追溯体系的监管作用和服务功能。
(三)加强宣贯培训,突出强调追溯平台的操作使用,医药进口企业建设追溯体系的主体责任,行业组织推进追溯体系建设、加强行业自律的典型经验,各方参与追溯体系建设的重要意义等。
本意见自2024年X月X日起实施。
附件:北京市临床急需进口药械和罕见病用药追溯系统建设方案
附件
北京市临床急需进口药械
和罕见病用药追溯系统建设方案
一、建设目标
贯彻落实国务院关于在北京天竺综合保税区建立罕见病药品保障先行区的工作任务,推动北京深化国家服务业扩大开放综合示范区建设,建设临床急需进口药械和罕见病药品追溯系统(以下简称“追溯系统”),实现品种全过程追溯。
二、建设原则
(一)统筹协同、多方共享。坚持总体建设,多方参与。系统由市药监局牵头建设,多方参与提需,共用共享,充分发挥信息化技术优势,高度依托我市“三医联动”工作机制和数据底座。
(二)标准规范、便捷实施。系统建设标准、追溯码标准、数据接口标准采用国际标准体系,适配主流在用物流扫码设备,减轻企业和医院对接技术负担。医生、患者扫码填报使用“京通”小程序,监管人员查看支持“京办”端,无需额外验证身份信息。
(三)安全稳定、持续优化。将信息系统安全和数据放在首位,基于市级政务云平台建设系统,建设和运维管理遵循不低于网络安全三级等保要求,确保系统的安全稳定运行。上线后根据业务量和需求持续迭代优化、持续丰富完善功能。
三、功能需求
(一)维护主数据
医药进口企业“白名单”中的企业(以下简称“企业”),对于纳入“白名单”的急需进口药械和罕见病药品品种(以下简称“品种”),在追溯系统中维护相关主数据,录入品种、医疗机构、追溯码等信息。
(二)保税区内赋码
企业在保税区内为产品赋追溯码。为尽量减少重复赋码,针对药品和器械不同情况,系统支持采用如下方案:
1.进口药品。进口药品各级销售包装单元,已有符合ISO/IEC 15459系列国际标准体系的编码和条码载体的,可以作为追溯码使用;没有符合ISO/IEC 15459系列国际标准体系的编码和条码载体的,在追溯系统中申请序列号,获得序列号发码信息,结合药品批号、有效期、生产日期信息,生成完整追溯码,通过赋码软件和条码打印机现场打印,按照《药品追溯码标识规范》,在各级销售包装单元贴码赋码。
2.进口医疗器械。已有UDI码,同时有PI(含序列号字段)的,可以作为追溯码使用。没有UDI码的或已有UDI码但没有序列号的,企业在追溯系统申请序列号,获取序列号发码信息,结合品种批号、失效期、生产日期信息,生成追溯码,通过条码打印机现场打印,在各级销售包装单元贴码赋码。
(三)企业上传追溯信息
企业可选择以下多种实施方案,上传赋码、包装、入库、出库、配送等追溯信息:
方式1:升级企业自身业务系统(如ERP、WMS、SCM等),支持“扫码通”标准的有线、无线条码扫描器,对接追溯系统接口,实现扫码出入库及上传追溯信息。
方式2:采用支持“扫码通”标准的手持PDA,通过PDA上APP实现扫码出入库和上传追溯信息。推荐中型企业采用。扫码通PDA及APP应追溯系统接口和支持“码上放心”等其它第三方药品追溯系统并实现自动分流,企业无需同时使用多种PDA。
方式3:自建或者采购符合ISO/IEC 19987:2017 EPCIS标准的L4级追溯系统,实现与追溯系统的对接。
方式4:市药监局建设追溯系统手机京通小程序端,采用人工扫码填报方式,上传出入库信息。推荐小型企业或追溯系统建设初期采用。
(三)医疗机构上传追溯信息
产品进入医疗机构后,医疗机构可上传收货、使用、拆零、带离、追访、召回等追溯信息,支持选择如下多种方案任意一种上传信息:
方式1:升级医疗机构自身业务系统(如HIS、HRP、WMS、SCM等),支持“扫码通”标准的快扫设备,实现中包装药品批量一次扫码获取多个追溯码。
方式2:升级SPD系统,实现医药进口企业配送前扫码发货,医疗机构收货时只需扫订单码或外箱码即可批量收货,上传追溯信息。推荐已有SPD系统的医院采用。
方式3:使用追溯系统京通小程序端扫码填报,上传入库和使用信息。该方式实现较快,但无法与医疗机构内部信息系统集成,推进初期使用,作为系统对接前的替代方案。
(四)查询统计功能
监管人员、医疗机构、企业等各方,支持PC页面和“京通”“京办”应用端查询追溯情况。监管人员端支持PC页面数据统计分析和“京办”端数据展示。
四、建设时间
追溯系统包含PC端、京通端、京办端,总体建设约需2-3个月。其中:需求沟通1.5个月(含建设方案征求各方意见,需进一步明确追溯系统中必填的字段信息);建设系统需1.5个月(含功能测试、安全测评等)。
附件:追溯系统对接数据规范
附件
临床急需进口药械和罕见病用药
追溯系统对接数据规范
一、适用范围
适用于需要与临床急需进口药械和罕见病用药追溯系统(以下简称“追溯系统”)数据采集接口进行对接的试点医药进口企业、医疗机构内部信息化系统的设计、开发测试和实施。
二、应用场景概述
(一)维护主数据
试点医药进口企业在追溯系统填报进口药品医疗器械主数据、企业信息、实体标识等基础数据。具体数据格式见资料性附录。
(二)保税区内赋码
试点医药进口企业在保税区内为药械产品赋追溯码并采集相关信息。符合相关要求的药品医疗器械产品,可以直接采集包装级联信息并上传;不符合的,赋码后,采集上传赋码信息、包装级联信息。
(三)保税区入库
试点医药进口企业在入库时,扫追溯码,由内部信息系统通过追溯系统接口上传入库信息。
(四)保税区出库
试点医药进口企业在出库时,扫追溯码,由内部信息系统通过追溯系统接口上传出库信息。
(五)经营配送环节收货、发货
试点医药进口企业出入库时扫码,上传入库信息、出库信息。
(六)医疗机构收货
医疗机构入库时扫码,上传入库信息。
(七)药品使用
医疗机构发药时扫码,上传药品使用信息。
(八)带药械离院
如需带离,医疗机构扫码上传带离信息。
(九)追访
带药离院后,患者应使用京通实名认证后上传用药信息,包括两张照片或两份视频,分别为每一独立包装的开启和最后一次使用的产品内包装照片或视频,所拍照片或视频应能查看到该独立包装的追溯码等关键信息。
带械离院后,患者应使用使用京通实名认证后上传用械信息,包括每一独立包装或带离专用包装的开启照片或视频,治疗使用期间至少每月上传一次照片或视频,所拍照片或视频应能查看到追溯码等关键信息。
(十)拆零
根据医师处方用量进行药物调配时,需要将药品拆开原包装后进行临床调配和使用的,由医疗机构扫码上传拆零信息。
(十一)召回
临床急需进口药械在境外被要求召回的,指定医疗机构应当立即停止使用,上传召回信息,并通知受托经营企业;受托经营企业应当立即停止配送并按照相关规定实施召回。供货企业如发现重大安全性风险需要召回的,应当通知指定医疗机构立即停止使用,上传召回信息,并主动召回。
(十二)销毁
临床急需进口药械需要销毁的,扫码上传销毁信息。
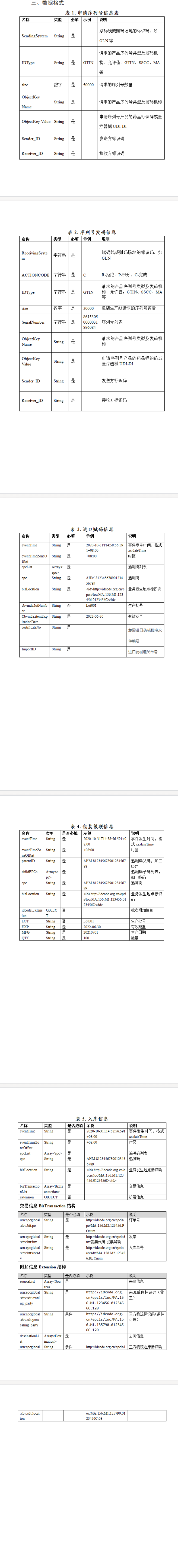
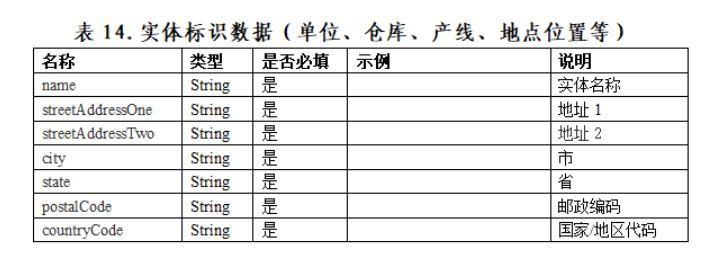
三、数据格式



附件1:《关于临床急需进口药械和罕见病药品追溯体系建设的指导意见(征求意见稿)》

摩熵医药2025-01-08

摩熵医药2024-12-17
Pharma CMC2024-10-15
摩熵医药(原药融云)2024-08-21
数屿医械2024-06-24
数屿医械2024-06-13
数屿医械2024-05-30
摩熵医药(原药融云)2024-05-27
药事纵横2024-02-28
药通社2023-12-26
2025-01-14
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-09
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-08
2025-01-07
2025-01-07
2025-01-06
2024-12-03
2024-09-24
2024-07-03
2024-06-11
2024-06-04
2024-05-27
2024-04-17
2024-04-17
2024-03-05
2023-12-11
2023-10-31
2023-10-30
2023-10-27
2023-09-28
2023-09-25
2024-12-03
2024-09-24
2024-08-21
2024-07-03
2024-06-17
2024-06-11
2024-06-04
2024-05-30
2024-05-27
2024-05-23
2024-04-28
2024-04-19
2024-04-17
2024-04-17
2024-03-27