
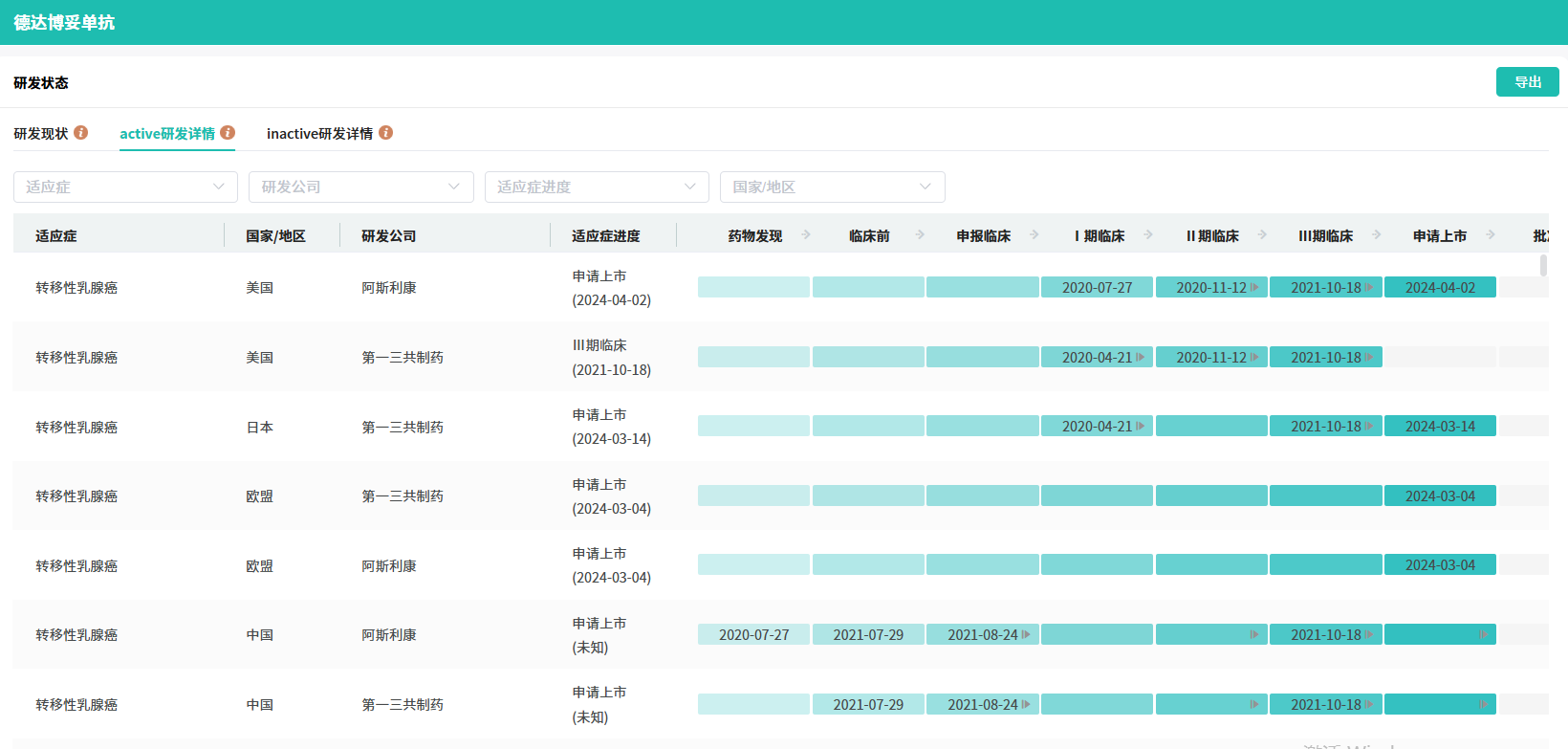
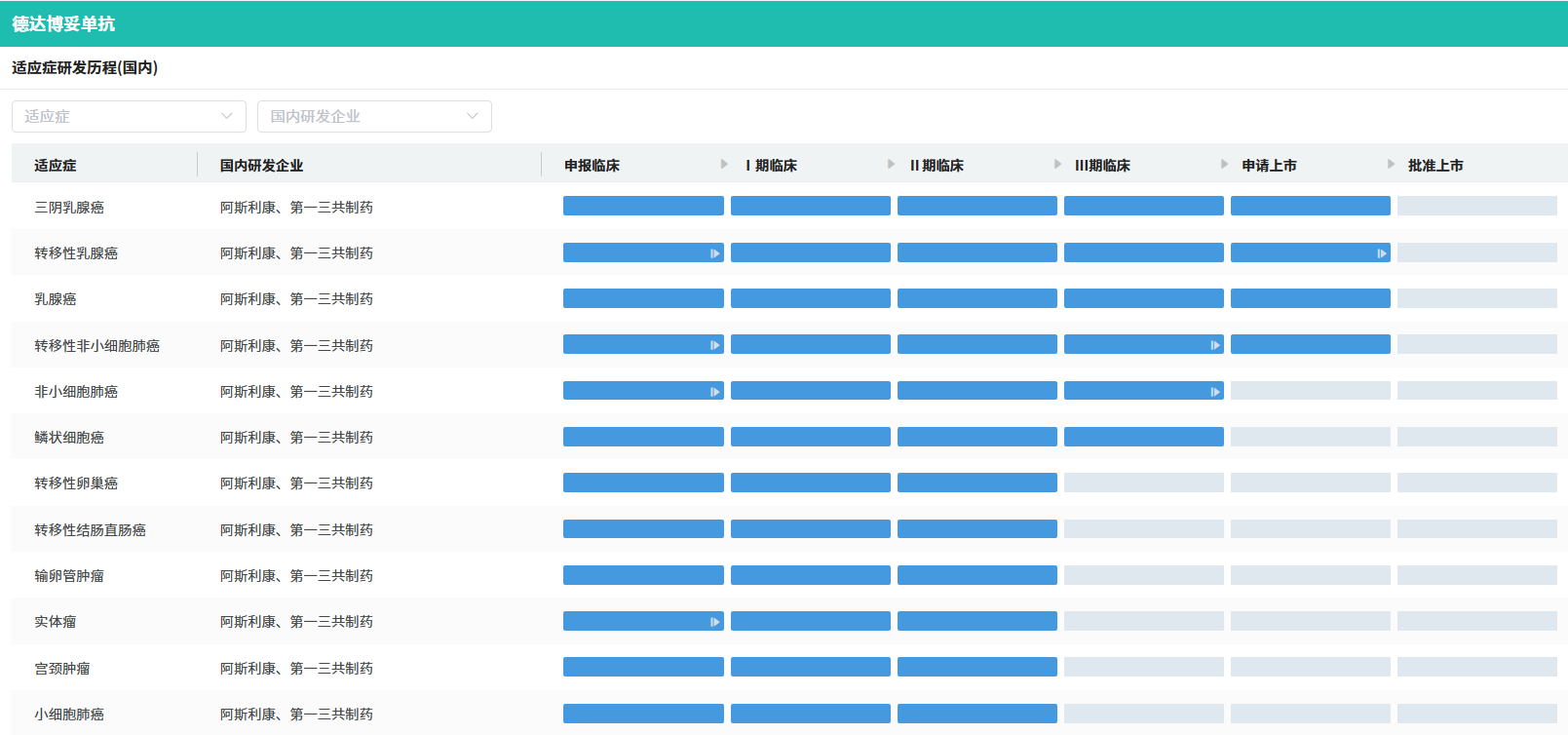
12月27日,第一三共宣布,其 TROP-2 ADC 产品Datopotamab deruxtecan(Dato-DXd ,德达博妥单抗,商品名:Datroway)在日本获批上市,用于治疗既往接受过化疗的成年人HR阳性、HER2阴性(IHC 0、IHC 1+或IHC 2+/ISH-)不可切除或复发乳腺癌患者,这也是datopotamab deruxtecan的全球首次获批上市,也是全球批准的第三款TROP-2 ADC药物。

DATROWAY(datopotamab deruxtecan)是一种基于TROP-2靶向的抗体药物偶联物(ADC),融合了第一三共独有的DXd ADC技术和阿斯利康ADC科学平台的尖端成果。它通过将人源化的抗TROP-2 IgG1单克隆抗体与拓扑异构酶I抑制剂负载物(DXd)通过四肽可裂解连接器GGFG相连,实现了DAR值为4的高效负载。这一创新设计使得DATROWAY能够精准靶向癌细胞,有效抑制其生长。
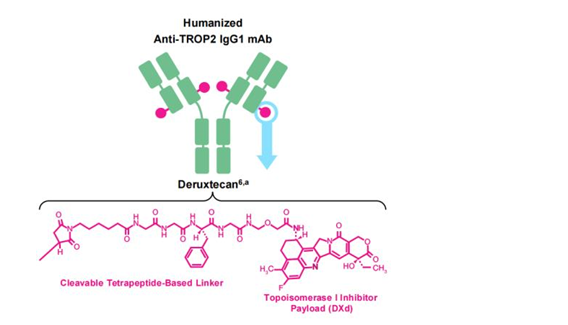
第一三共高级顾问高崎渡博士指出,DATROWAY(datopotamab deruxtecan)的全球首个批准为日本HR阳性、HER2阴性转移性乳腺癌患者提供了一种全新的治疗选择。相较于传统化疗,DATROWAY有望带来更高的响应率,从而改善患者的生活质量。同时,这也是第二个基于第一三共DXd技术的抗体药物偶联物在日本获批,进一步彰显了第一三共在癌症创新治疗领域的领先地位和坚定承诺。









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论