
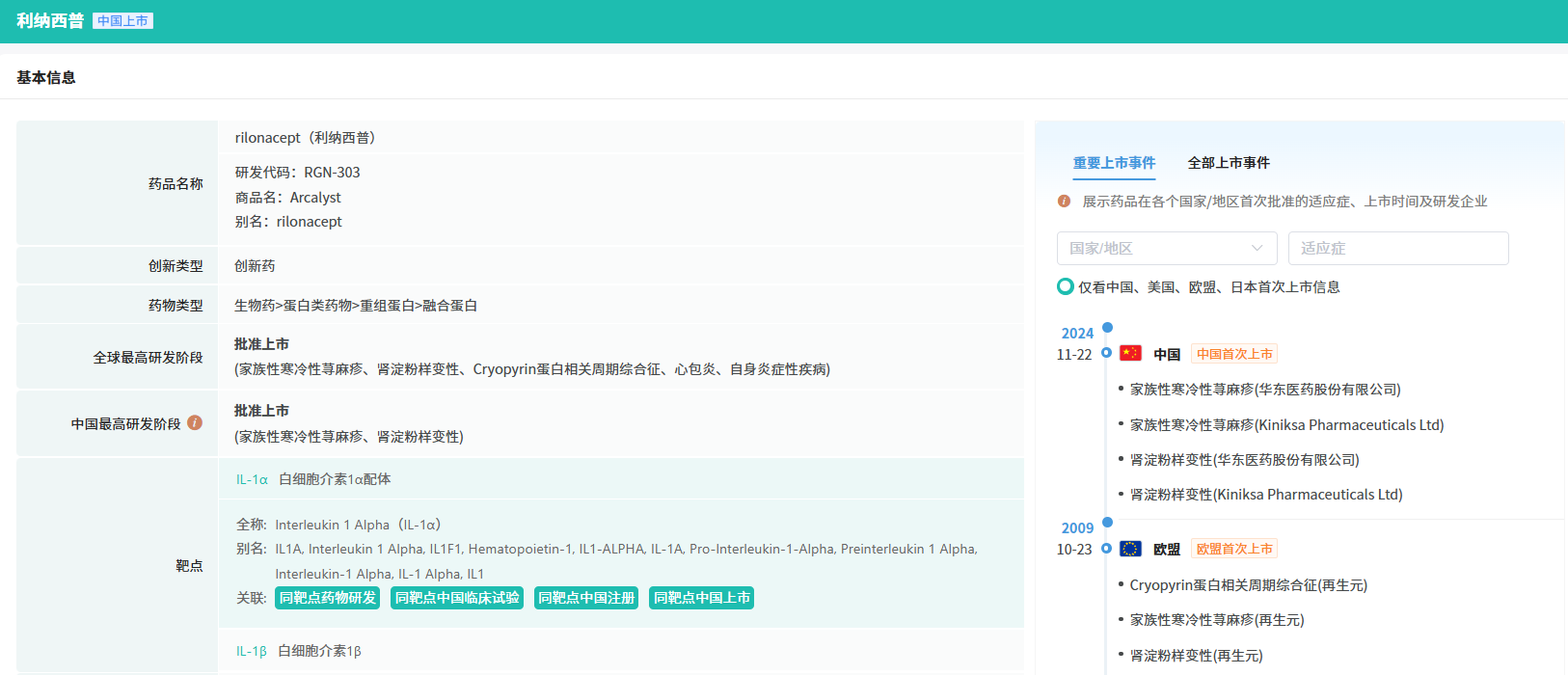
12月10日,据NMPA官网最新公示,华东医药全资子公司中美华东申报的注射用利纳西普新适应症上市申请已获得批准。这是中美华东与Kiniksa Pharmaceuticals的全资子公司携手研发的一款IL-1抑制剂,已于今年11月在中国率先获得批准,用于治疗冷吡啉相关周期性综合征(CAPS)。根据CDE的优先审评公示,该药物新增适应症为:治疗成人及12岁及以上青少年复发性心包炎(RP),并有效降低复发风险。

截图来源:NMPA官网
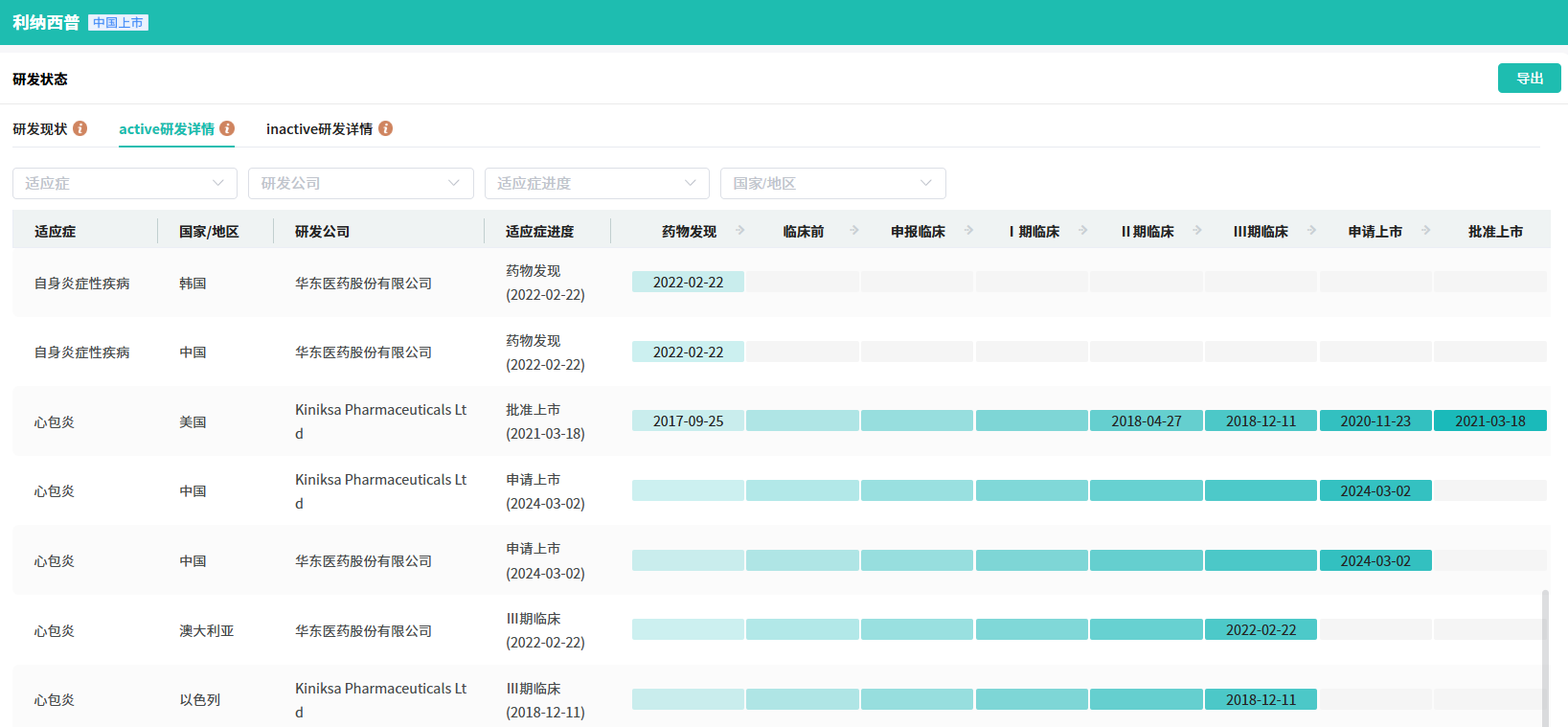
利纳西普是一种重组二聚体融合蛋白,通过阻断IL-1α和IL-1β信号传导进行治疗。该产品2008年2月获美国FDA批准,用于治疗冷吡啉相关周期性综合征,包括家族性寒冷性自身炎症综合征和Muckle-Wells综合征;2020年12月新增适应症IL-1受体拮抗剂缺乏症(DIRA);2021年3月再添复发性心包炎适应症,成为FDA唯一批准用于12岁及以上复发性心包炎患者的药物。
截图来源:摩熵医药数据库(全球药物研发数据库)
复发性心包炎是一种罕见的自身炎症性心血管疾病,已被列入中国《第二批罕见病目录》。患者常经历反复胸痛发作,并面临危及生命的并发症,严重妨碍了日常活动。当前标准疗法包括非甾体类抗炎药(NSAIDs)、秋水仙碱和皮质类固醇(CS),但长期应用尤其是CS,可能引发安全问题。白介素-1(IL-1),特别是心包中的IL-1α和IL-1β,是驱动此病病理生理过程的关键细胞因子。它们引发组织损伤后,会刺激分泌更多IL-1,从而持续加剧心包炎症。
截图来源:摩熵医药全球药物研发数据库
在中国,注射用利纳西普2018年入选《临床急需境外新药名单》。2022年2月,中美华东与Kiniksa达成6.62亿美元合作,获得包括注射用利纳西普在内的两款自身免疫疾病药物权益。中美华东独家拥有该药品在24个亚太国家和地区(除日本)的开发、注册及商业化权利。
此外,注射用利纳西普在国际上进行的关键性临床数据显示,其能治疗12岁及以上青少年复发性心包炎并降低其复发风险,在美国获批后的临床经验也表明本品治疗RP具有显著的疗效和良好的安全性。
参考来源:
[1] NMPA官网
[2] 摩熵医药(原药融云)数据库
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论