
作为全球肿瘤治疗的热门靶点,PARP抑制剂(多聚ADP核糖聚合酶)在DNA单链损伤修复过程中发挥着重要作用,因此PARP抑制剂也成为个性化抗肿瘤药物中较为典型的代表之一。
上一期文章我们解析了PARP及其抑制剂的作用机制(《卵巢癌治疗热门药物:PARP抑制剂的作用机理解析》),这一期我们继续来分析一下PARP抑制剂的市场竞争格局、研发进展及适应症动态。
一、PARP抑制剂国内外市场销售
- 1.PARP抑制剂全球市场销售情况
据药融云数据统计,PARP抑制剂2021年全球销售额突破30亿美元,而奥拉帕利占局PARP抑制剂市场份额70%,成为阿斯利康重磅产品。
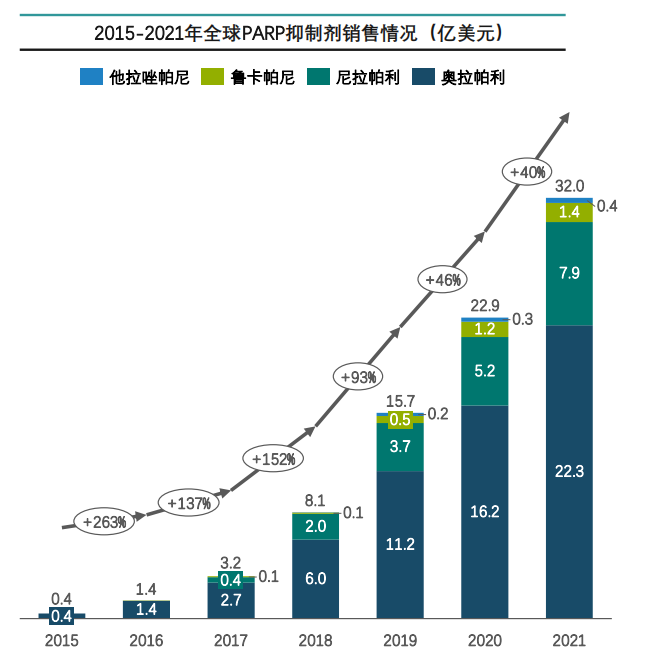
图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
总的来说,目前在PARP抑制剂的全球销售中,美国和欧洲五国(英法德西意)是PARP抑制剂最大的市场,占总销售额的70%以上;近年美国在全球的销售额占比下降,但依旧达到销售额的40.8%;中国和日本是PARP抑制剂增长迅速的地区,尤其中国市场的潜力巨大。加之奥拉帕利进入国家医保目录,未来中国销售额将快速提升。
奥拉帕利是阿斯利康和默沙东联合开发的一款“first-in-class”PARP抑制剂。它靶向DNA损伤修复反应(DDR)通路,利用“合成致死”原理,在杀伤癌细胞的同时,不影响健康细胞。
通过【药融云全球药物研发】数据库可以看到,2018年8月23日,PARP抑制剂奥拉帕利在中国正式获批上市,成为中国首个用于铂敏感复发性卵巢癌的维持治疗的卵巢癌靶向药。
奥拉帕利上市时间轴

图片来源:药融云全球药物研发数据库
2019年11月29日,奥拉帕利再次获批用于BRCA突变的晚期卵巢癌的一线维持治疗。2021年6月,又获批治疗携带BRCA1/2突变的转移性去势抵抗性前列腺癌。
在此之前,奥拉帕利已经获得美国FDA批准,治疗携带种系BRCA突变的晚期卵巢癌、乳腺癌、胰腺癌等多种癌症类型。奥拉帕利也是目前在四大不同癌种(卵巢癌、乳腺癌、胰腺癌及前列腺癌)均取得阳性结果的PARP抑制剂。
奥拉帕利针对不同适应症的研发状态
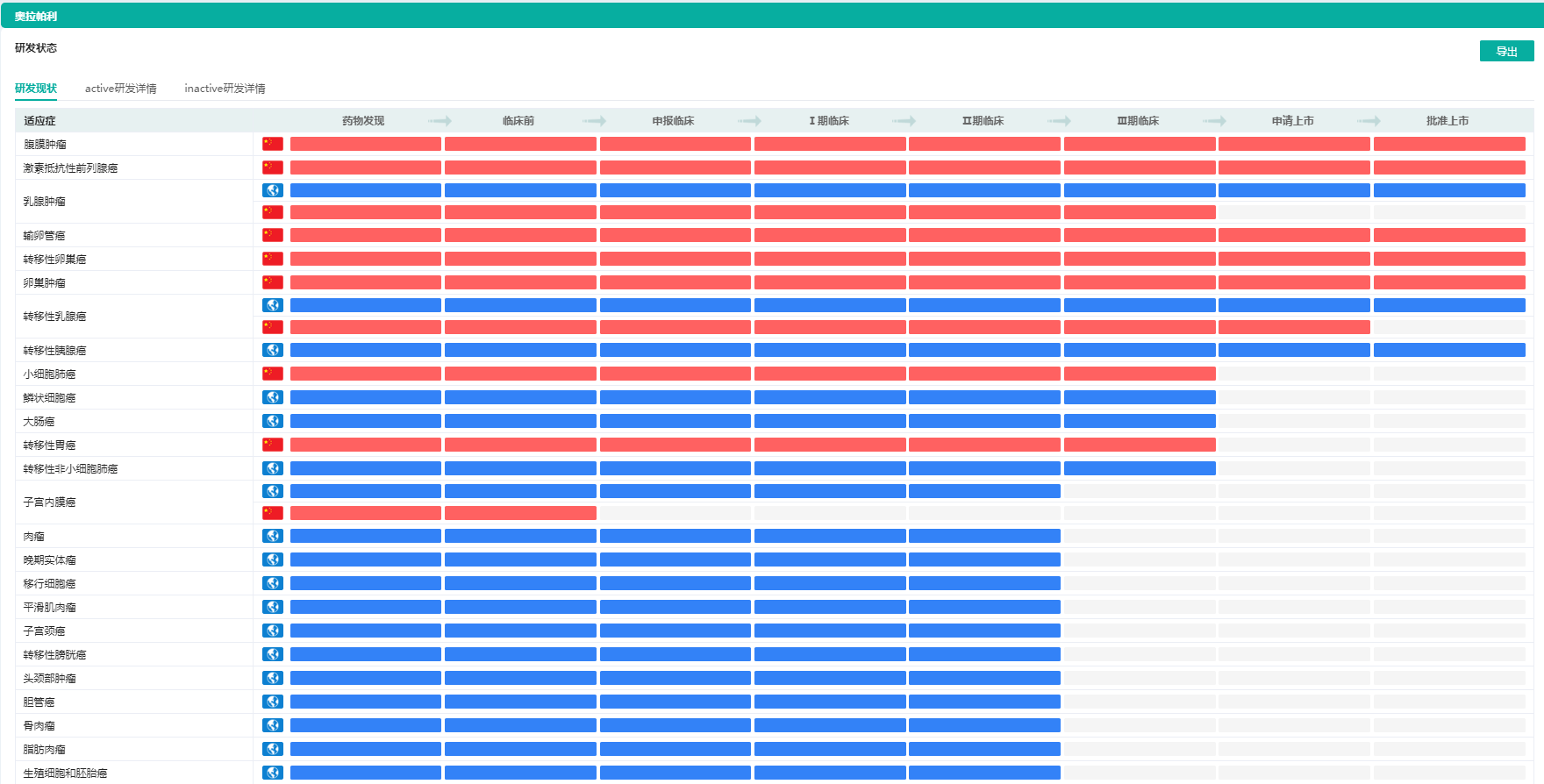
图片来源:药融云全球药物研发数据库
据弗若斯特沙利文报告,全球范围内PARP抑制剂市场增长迅速,2020年达到24亿美元,预计未来市场规模将以38.3%的复合年增长率增长,2025年达到123亿美元。
随着适应症不断拓展,PARP抑制剂的市场将进一步扩大,未来依旧有较大的增量潜力,异癌同治将会在肿瘤治疗中越来越普遍。
- 2.PARP抑制剂中国市场销售情况
在国内,PARP抑制剂目前已成为创新公司的热门研究领域。积极布局PARP抑制剂新药研发的企业不在少数,如再鼎医药的尼拉帕利、恒瑞医药的氟唑帕利、百济神州的帕米帕利等;涉及适应症包括卵巢癌、前列腺癌、乳腺癌、胃癌等。
据药融云数据统计,2021年中国PARP抑制剂销售额接近20亿元,并以奥拉帕利/尼拉帕利主导,帕米帕利/氟唑帕利未来有较大增长潜力。
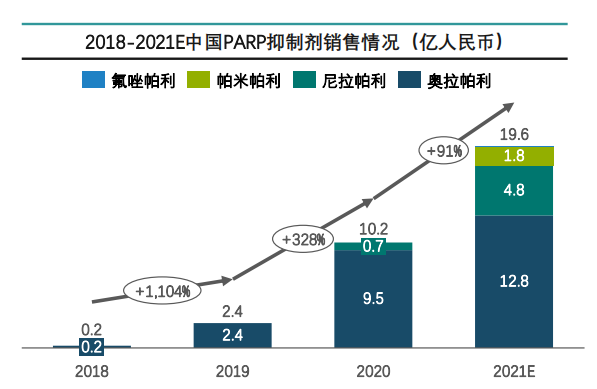
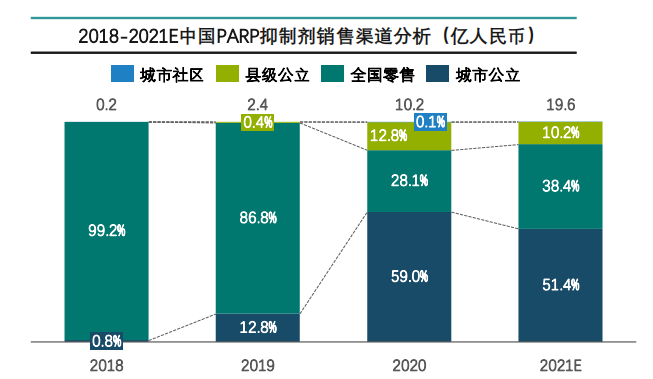
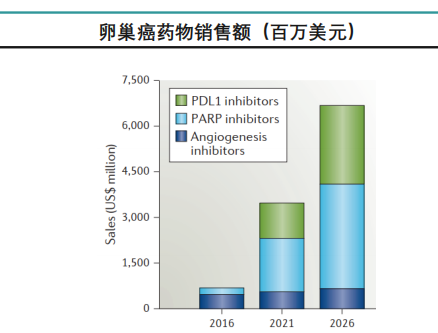
图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
自2014年奥拉帕利问世以来,全球已上市六款PARP抑制剂,分别是奥拉帕利、鲁卡帕利、尼拉帕利、他拉唑帕利、氟唑帕利和帕米帕利。在我国获批上市的有4款:奥拉帕利、尼拉帕利、氟唑帕利和帕米帕利。值得一提的是,我国批准的4款PARP抑制剂均通过医保谈判进入2021年国家医保,市场增长潜力巨大。

图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
其中,尼拉帕利是目前医保目录中唯一实现全人群报销的PARP抑制剂,以其临床优势和良好的可及性填补了卵巢癌全人群一线维持治疗医保报销这一空白,为满足广大卵巢癌患者的迫切需求贡献了力量。
而帕米帕利是适用于携带致病或疑似致病的胚系BRCA 突变且既往接受过两线或两线以上化疗的晚期卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。它也是中国目前获批的同时拥有铂类药物敏感的卵巢癌(PSOC)和铂类药物耐药的卵巢癌(PROC)治疗适应症的PARP抑制剂。
帕米帕利不同适应症研发状态
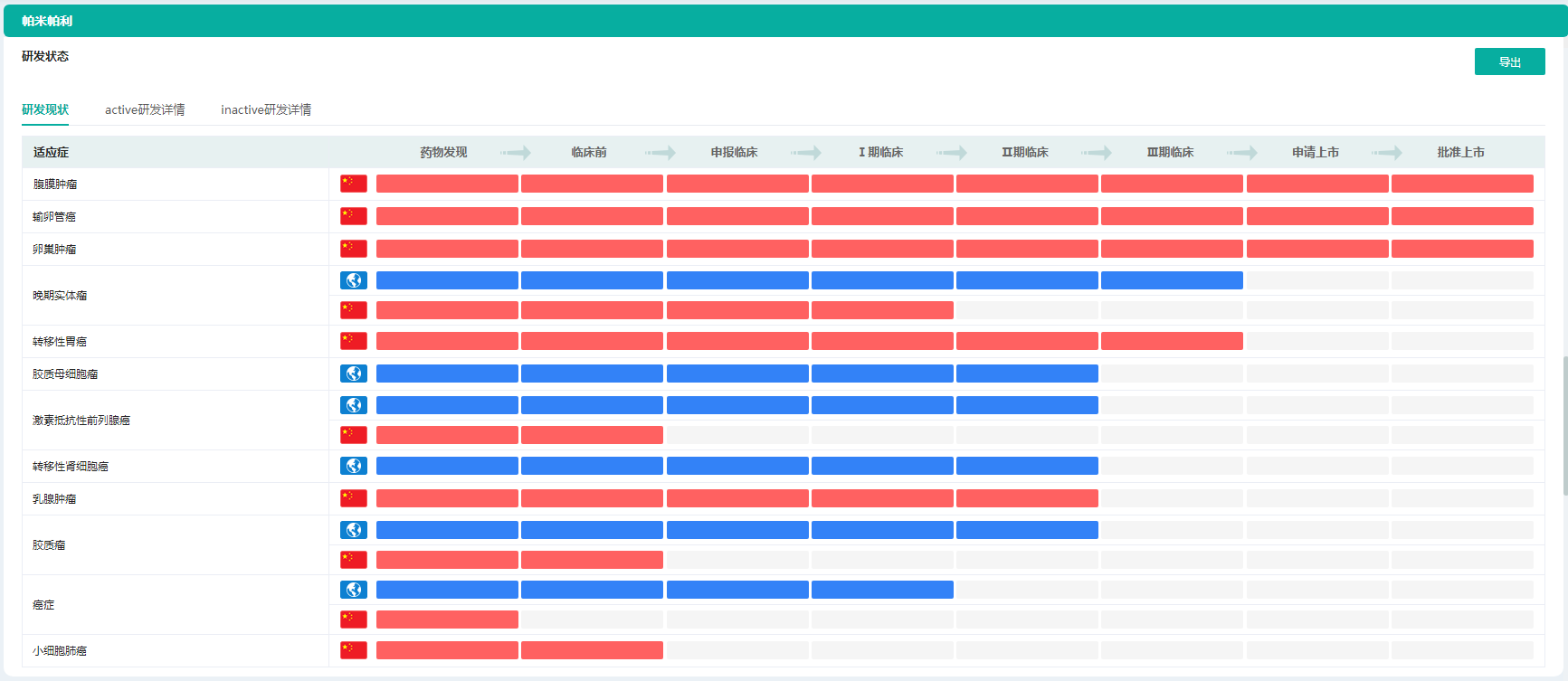
图片来源:药融云全球药物研发数据库
氟唑帕利是国内首个上市的中国原研PARP抑制剂,先后斩获≥3线的gBRCAm铂敏感复发卵巢癌的治疗、铂敏感复发性卵巢癌维持治疗两大适应症,还获得了国内两大权威指南的推荐。
据药融云中国临床试验数据库显示,除卵巢癌外,氟唑帕利还有20余项临床试验正在开展,涉及前列腺癌、复发转移三阴性乳腺癌、胰腺癌、晚期胃癌等领域。
氟唑帕利临床试验信息
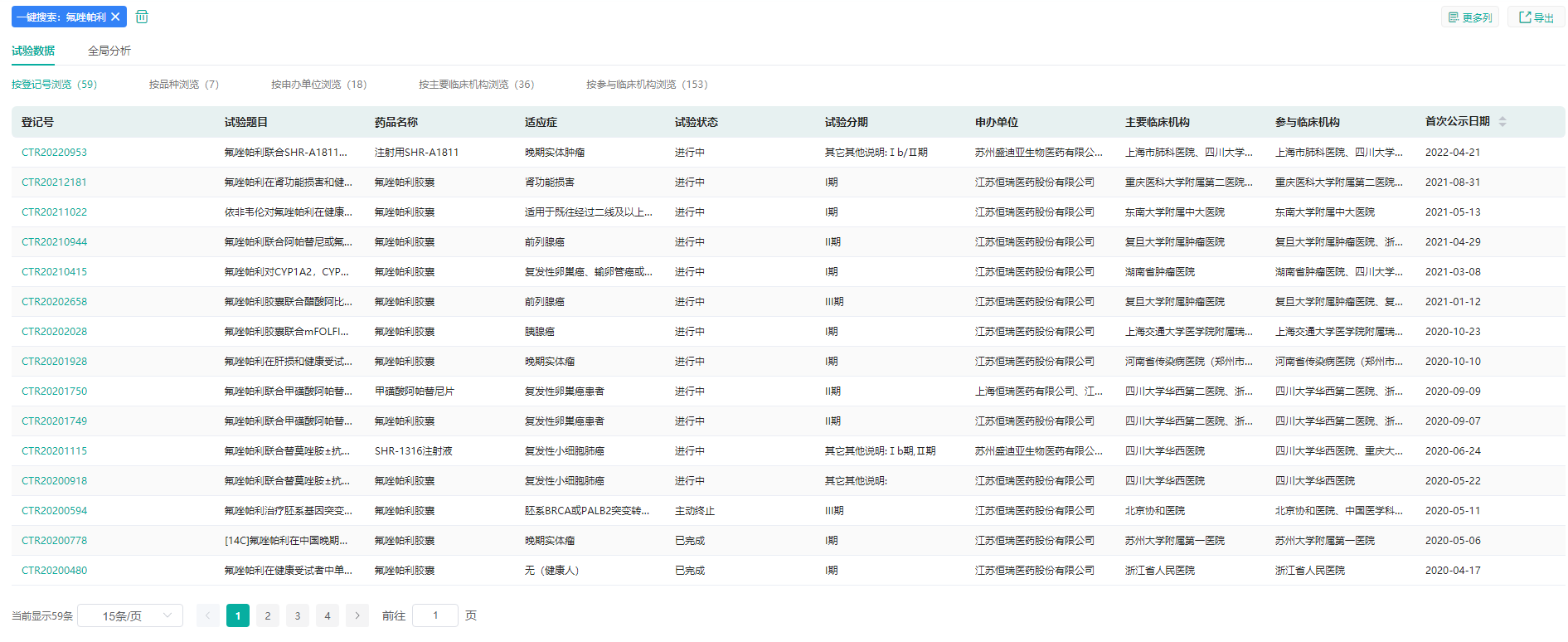
图片来源:药融云中国临床试验数据库
二、PARP抑制剂研发进展及适应症动态
自2005 年Bryant 等提出“合成致死”概念以来,PARP抑制剂的潜在抗肿瘤作用逐步被揭示。随着基因组学的发展,人们对肿瘤分子水平的认识不断加深,与DNA修复途径相关的分子靶向药物逐渐引起了人们的关注。
PARP抑制剂大事件盘点
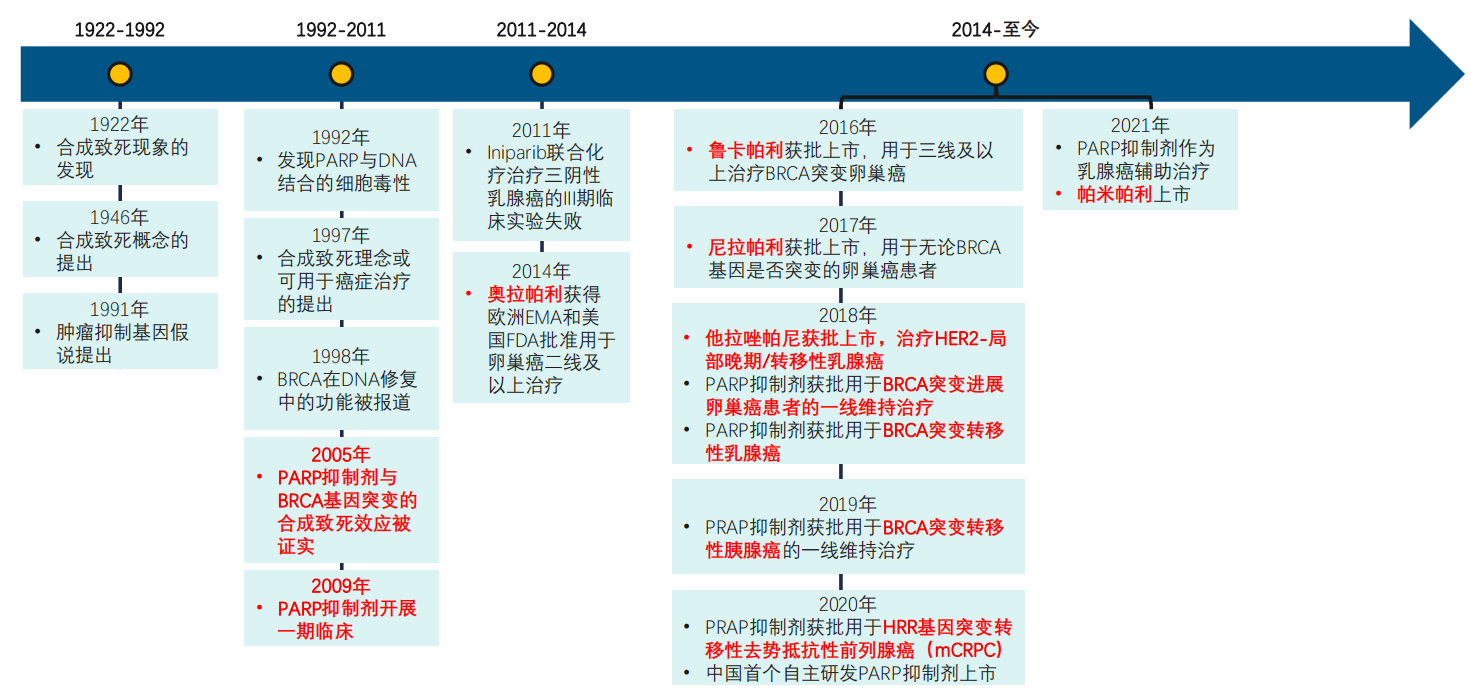
图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
基于合成致死的PARP抑制剂研发的十几年间,异癌同治下其适应症逐步拓展。目前PARP抑制剂在卵巢癌、乳腺癌、前列腺癌、胰腺癌等实体瘤均有较为明显的患者受益。
据药融云数据统计,PARP抑制剂全球已上市及研发状态的药物合计65个,在中国处于研发状态的药物合计24个,目前依旧是肿瘤的研发热门靶点。
PARP抑制剂全球及中国药物研发概览
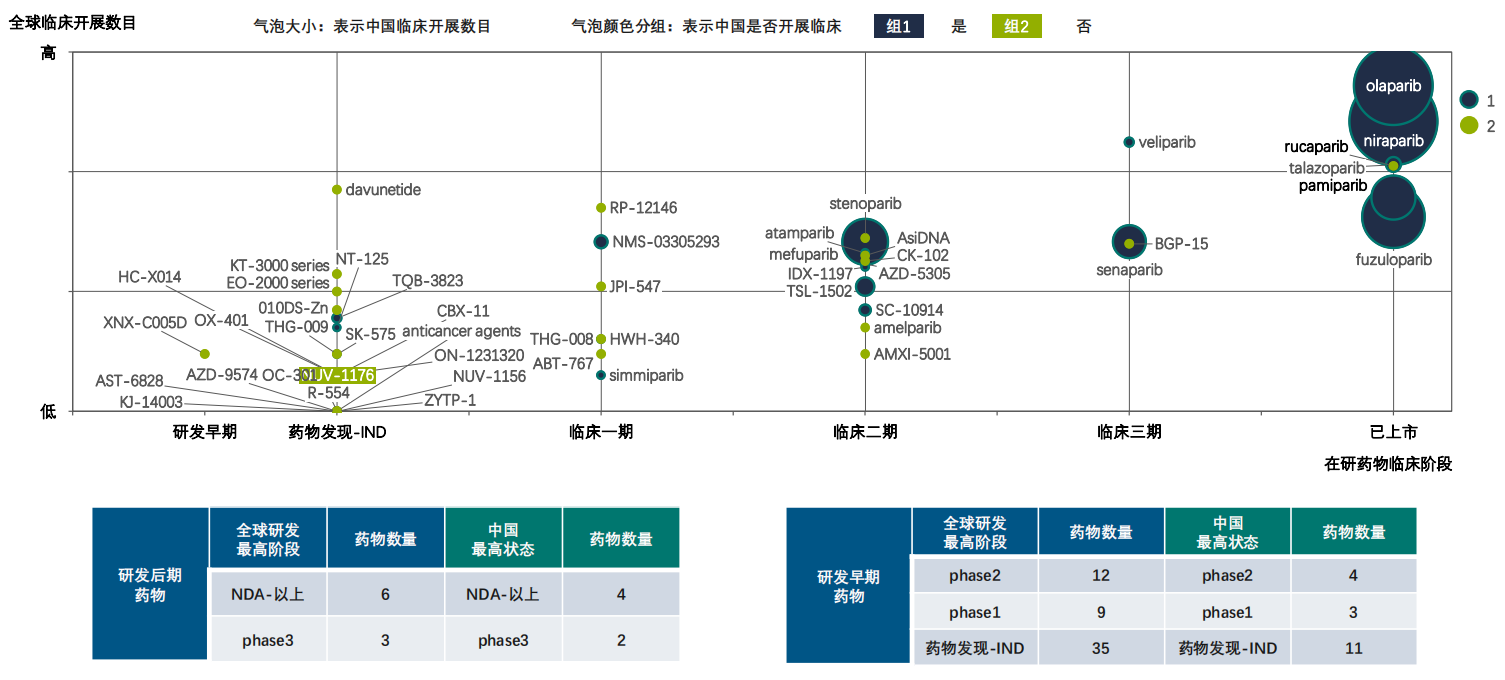
图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
HRD在多个瘤种中存在突变,PARP抑制剂针对HR修复缺陷对肿瘤细胞的合成致死作用大有可为。
近年来的研究发现,PARP-1 抑制剂单药对 BRCA1/2突变的乳腺癌及卵巢癌细胞有明显抑制作用。若肿瘤细胞存在HR修复缺陷(如BRCA1/2突变),DSB将无法修复,即导致所谓的PARP-1抑制剂和 HR 修复缺陷对肿瘤细胞的合成致死作用。
HR 修复是个复杂的过程,许多基因和蛋白成分参与其中,包括ATM、ATR、CHK1、EMSY、PTEN、RAD51及其同系物如FANC蛋白、MRE11、RAD50、NBS1 等,BRCA1/2 只是其中的重要成分之一。HR 修复途径中的任一基因突变或表达沉默,即会引起 HR 修复途径缺陷,PARP-1 抑制剂即可能通过合成致死作用发挥抗肿瘤活性。

图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
另外,PARP-1 抑制剂还可作为放(化)疗增敏剂发挥抗肿瘤作用。许多化疗药物(如烷化剂、铂类、拓朴异构酶Ⅰ/Ⅱ抑制剂等)和放疗均通过直接或间接损伤 DNA 来发挥对肿瘤细胞的杀伤作用。
由于PARP-1在DNA损伤修复中起关键作用,可将PARP-1抑制剂作为放(化)疗增敏剂与放(化)疗联用,增强抗肿瘤疗效。同时,还可因此减少放(化)疗用药或放射剂量,降低毒副作用。
HR-DDR(homologous recombination DNAdamage repair)突变的总频率约为17.4%,ARID1A是HR通路中最常见的突变基因(7.2%),其次为BRCA2(3.0%)、 BRCA1(2.8%)、ATM(1.3%)等。
最常见的突变瘤种为:子宫内膜癌34.4%,胆道癌28.9%,膀胱癌 23.9%,肝细胞癌 20.9%,卵巢癌 20.0%。
与此同时,PARP抑制剂作为“合成致死”明星产品,在多个实体瘤均有布局,早期的适应症还包含了炎症、心血管、CNS等领域。据药融云数据统计,目前已获批上市的PARP抑制剂适应症数量为6个,处于phase3阶段的7个,处于phase2阶段的12个,处于phase1阶段的11个,处于IND及以前的19个。
全球PARP抑制剂开发的临床适应症开发概览
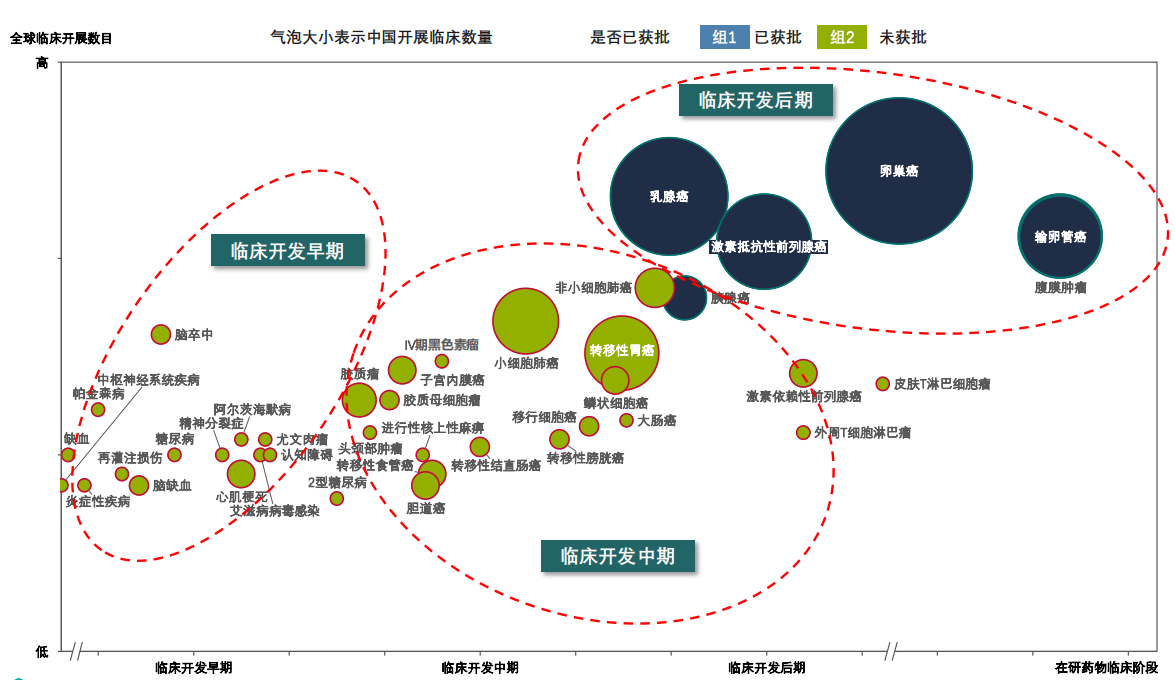
图片来源:药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》
据药融云全球药物研发数据库显示,从PARP抑制剂在研药物的适应症看,其中针对乳腺肿瘤药物25个(包括药物发现,临床前,I,II,III期临床,批准上市、研究终止、无后续进展报道),卵巢肿瘤药物18个,实体瘤药物24个,晚期实体瘤药物24个,转移性乳腺癌药物16个,转移性卵巢癌药物14个,小细胞肺癌药物12个等。
PARP抑制剂不同适应症药物研发数量
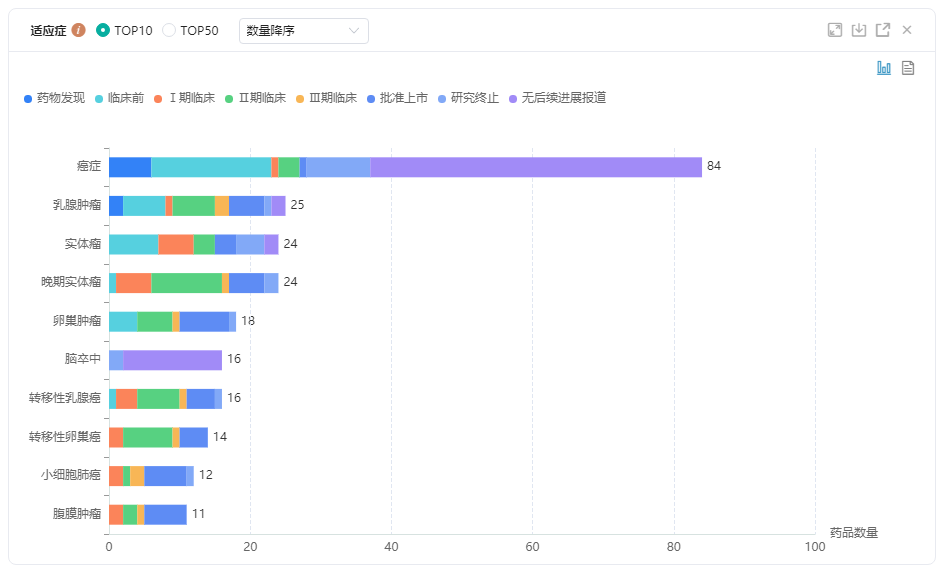
图片来源:药融云全球药物研发数据库
目前,PARP抑制剂针对小细胞肺癌、非小细胞肺癌的研究也已进入III期临床,食管癌、结直肠癌、肾癌、子宫内膜癌、宫颈癌、黑色素瘤、膀胱癌、白血病等适应症也在探索当中。
预计未来将陆续有PARP抑制剂新产品获批上市,不断扩大其市场规模。PARP抑制剂有望成为像PD-1一样的多癌种抗肿瘤药。
注:下一期我们会继续解析PARP抑制剂适应症的拓展,敬请关注。想要获取药融云《多聚ADP核糖聚合酶(PARP)靶点市场及研发分析报告》完整内容,关注“药融云”公众号(gh_d20f87bd52d9),回复关键词“PARP抑制剂”即可领取。
想要解锁更多抑制剂靶点信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握抑制剂靶点产品布局、上市情况、药企研发情况、市场竞争格局、最新进展、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论