
晚间,恒瑞医药披露,子公司苏州盛迪亚生物医药有限公司获得了自主研发的1类新药夫那奇珠单抗注射液的上市批准,该药用于治疗适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者,作用靶点也是IL-17A。
01
从今年前两个季度的销售数据来看,赛诺菲与再生元联合开发的度普利尤单抗 (Dupixent®) 一马当先,以66亿美元的销售额与一众自免竞品拉开差距,新王的王座貌似已坐稳。
 来源:各药厂一、二季度报半年报
来源:各药厂一、二季度报半年报Dupixent®是注射用IL-4Rα拮抗剂,经FDA批准可用于五种疾病:湿疹(特应性皮炎)、哮喘、慢性鼻窦炎伴鼻息肉、嗜酸性食管炎、结节性痒疹。2017年3月首次获得FDA批准。不出意外的话,今年Dupixent®会彻底取代Humira®的王者之位。
更让人激动的是,7月,Dupixent®已在欧洲获批用于慢性阻塞性肺病 (COPD),要知道,十多年了,这是首个治疗COPD的新方法,也为欧盟约22万成年人提供了新选择。在美国、日本、中国的审批也已在进行中,我们不妨期待一下。待批的适应症还有慢性自发性荨麻疹(欧洲)。
Dupixent®在水疱性天疱疹、起因不明的慢性瘙痒、慢性自发性荨麻疹(美国)、嗜酸细胞性胃炎的临床试验也已进行至三期。
相比Dupixent®明显领先的优势,次席的情形尚不明朗。目前暂居第二位的是强生的乌司努单抗 (Stelara®),但是它与Humira®和艾伯维的后浪利生奇珠单抗 (Skyrizi®) 相差不大。Humira®已在走下坡路,预计不会对Stelara®构成威胁,但Skyrizi®还有翻盘的机会。
Stelara®是首款靶向IL-12和IL-23的药物,用于治疗银屑病、银屑病性关节炎、克罗恩病、溃疡性结肠炎。2008年首次于加拿大获批。目前该药还有两种适应症正在审批中,分别是小儿青少年银屑病性关节炎和小儿克罗恩病。
值得注意的是,该药目前只有一款管线在研了,是小儿溃疡性结肠炎,进行至三期试验。目前强生的免疫管线中,最多的是古塞奇尤单抗 (TREMFYA®)和丽铂卡利 (nipocalimab)。这或许与Stelara®去年九月在美国的专利开始到期有关,强生早已开始未雨绸缪。这也是或许它会被Skyrizi®后来居上的原因。
TREMFYA®是首个获批的全人双作用单克隆抗体,可与IL-23上的p19亚基结合,亦可与CD64结合,阻断IL-23,CD64是一种受体,位于产生IL-23的细胞上。IL-23是炎症性疾病发病机制的重要驱动因子。目前进行中的试验包括小儿溃疡性结肠炎、小儿青少年银屑病性关节炎、小儿克罗恩病、溃疡性结肠炎皮下诱导、银屑病关节炎结构损伤、小儿银屑病。
Nipocalimab是强生于2020年通过收购Momenta获得的资产,是经过临床验证的、潜在同类最佳的抗新生儿 Fc 受体 (FcRn) 抗体。目前进行中的试验包括胎儿新生儿溶血病、温热自身免疫性溶血性贫血、特发性炎性肌病、干燥症、系统性红斑狼疮、类风湿性关节炎。
艾伯维的Skyrizi®同样是IL-23抑制剂,与IL-23的p19亚基结合,阻断IL23。2019年4月首次获得FDA批准,目前可治疗斑块型银屑病、银屑病性关节炎、克罗恩病和溃疡性结肠炎。
今年6月,FDA批准Skyrizi®用于中重度溃疡性结肠炎,标志着Skyrizi®成为首个获批既可用于中度至重度溃疡性结肠炎又可用于中度至重度克罗恩病的IL-23特异性抑制剂,彰显了艾伯维在炎症性肠病 (IBD) 领域扩张的雄心。
MNC自免布局的一大特点是不断扩大适应症范围,其中,艾伯维尤其看重IBD。仅今年上半年,艾伯维就已四度出手IBD:
3月20日,艾伯维与Parvus Therapeutics宣布签署全球独家许可合作和选择权协议,结合艾伯维在免疫学上的专业技术和Parvus富有创新性的调节性T细胞 (Treg) 免疫耐受平台技术Navacim™,开发IBD疗法。
3月25日,艾伯维购买了专注于为自免疾病病人开发新颖口服疗法的临床阶段生物制药公司Landos Biopharma, Inc.,获得了NX-13,一种同类首创口服NLRX1激动剂(NOD样受体家族成员之一),具有双向作用机制,可以抗炎,有助于上皮修复。
6月13日,艾伯维与北京明济生物有限公司宣布签署许可协议,共同开发FG-M701,这是治疗IBD的下一代TL1A抗体,目前处于临床前开发阶段,是靶向TL1A的完全人类单克隆抗体,TL1A是经过临床验证的IBD靶点。
6月30日,艾伯维以2.5亿美元的价格收购初创公司Celcius Therapeutics,后者的主导项目是CEL383,这是一种用来阻断TREM1蛋白的抗体。TREM1起加重炎症的作用,在某些免疫细胞上表达,是其他炎症通路的上游,充当炎症放大器。
JAK抑制剂乌帕替尼 (Rinvoq®) 同样来自艾伯维,它可以在细胞内发挥作用,阻断某些被认为会引起炎症的信号,可治疗8种炎症疾病,含类风湿性关节炎、银屑病性关节炎、湿疹。2019年8月首次获得FDA批准,迄今已获得7次FDA批准。7月,艾伯维向FDA提交了用Rinvoq®治疗新适应症成人巨细胞动脉炎 (GCA) 的申请,GCA是一种影响大中型动脉的自免疾病。去年7月,Rinvoq®获得中国国家药品监督管理局 (NMPA)的批准,成为国内首个口服高选择性JAK抑制剂,用于治疗成人中重度活动性克罗恩病。
艾伯维对两位后起之秀Skyrizi®和Rinvoq®寄予了厚望,认为它们2025年各自的销售额都可以超过75亿美元。
虽然修美乐已让位于Dupixent®,但是不同于艾伯维三驾马车齐头并进,赛诺菲在自免领域只有Dupixent®一个重磅炸弹药物。所以,对比艾伯维与赛诺菲的半年报可以发现,“自免一哥”仍是艾伯维。


托珠单抗 (Actemra/RoActemra) 作为罗氏在自免领域的当家花旦,2010年1月首次获得FDA批准。可用于治疗类风湿性关节炎、小儿幼年特发性关节炎、系统性青少年特发性关节炎、巨细胞动脉炎、系统性硬化症相关间质性肺疾病、CAR-T诱导的细胞因子释放综合征,最近一次获批是用于治疗新冠。
02
随着MNC竞争日趋白热化,国内企业也不可能作壁上观,坐视市场被外人瓜分。毕竟,Dupixent®自从2020年首次进入国家医保,销售额已翻了近10倍。
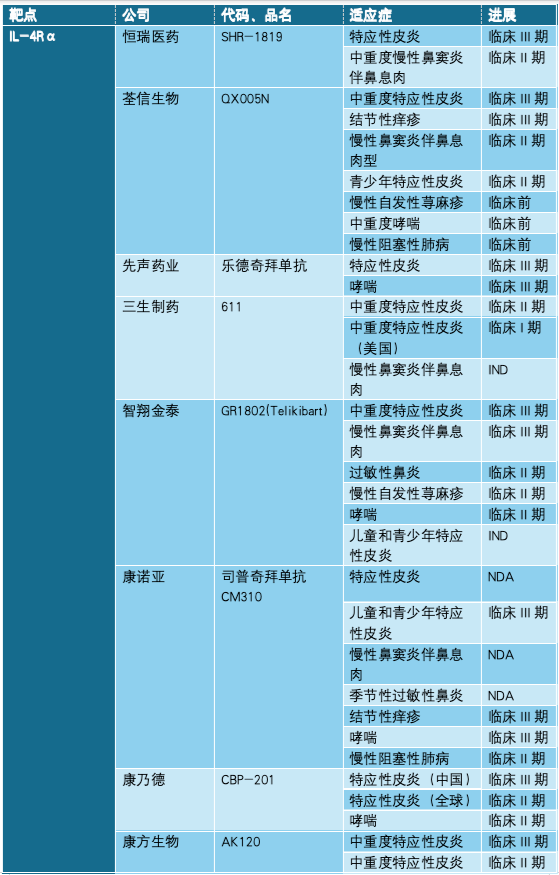


国内部分免疫管线一览,来源:各公司官网
很明显,IL-4Rα是吸引最多火力的靶点,这或许是受到Dupixent®这个爆款大单品的影响。从进展来看,康诺亚的司普奇拜单抗CM310跑得最快。另外,除三生制药以外,每一家都有项目进行到三期,肉眼可见,未来几年,这个赛道将迎来扎堆上市。如何保持差异化、在竞争中脱颖而出,将成为入局者不得不面对的挑战。
如果说白介素是生物制剂的代表,那么JAK1就是小分子抑制剂的代表。JAK1是JAK家族四种亚型之一(另外三种分别是JAK2、JAK3、TYK2),是多条信号通路的核心,也是唯一可以与其他三种亚型都形成异二聚体的亚型,因此,它与多种炎症、自免疾病关系密切,也因此,我们看到所有JAK抑制剂的研发都集中在JAK1上。目前,国内属恒瑞医药的进度最为领先。
写在最后
在国际舞台上,自免是仅次于肿瘤的第二大疾病领域;在中国,MNC起步早,获得了一些先发优势。然人无常态,事无常规,江山代有才人出,各领风骚数百年。Humira®的衰落,是Dupixent®崛起的希望,今日MNC的领先,未尝不是培育他日国产自免创新药物的沃土。百舸争流,谁又能知,苍茫大地,谁主沉浮?
本公众号所有转载文章系出于传递更多信息之目的,且明确注明来源和作者,不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。所有文章仅代表作者观点,不代表本站立场。
<END>

【关于生物药知识云享】
“生物药知识云享”围绕我国生物医药产业链,专注于生物制药行业资讯整理,分享行业动态,前沿技术,政策法规等,旨在给大家提供资料参考,欢迎大家扫码关注,也欢迎广大生物医药同仁提供建议,谢谢






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论