声明:因水平有限,错误不可避免,或有些信息非最及时,欢迎留言指出。本文仅作医疗健康相关药物介绍,非治疗方案推荐(若涉及);本文不构成任何投资建议。
和誉港股新上市,和誉-B,02256.HK
为一家临床阶段的生物制药公司,致力于发现及开发创新且差异化的小分子肿瘤疗法。自2016年成立以来,已战略性地设计及开发由14个专注于肿瘤学的候选药物组成的管线,包括五种处于临床阶段的候选药物。候选产品主要为注重小分子肿瘤精准治疗及小分子肿瘤免疫治疗领域的小分子药物。拥有两款核心候选产品ABSK011及ABSK091以及12款其他管线候选产品。自主研发的ABSK011是一种有效的高选择性小分子成纤维细胞生长因子受主4(FGFR4)抑制剂;ABSK091(从AZ获得许可,前称为AZD4547)是一种分子靶向候选产品,是FGFR亚型1、2及3的高效及选择性抑制剂。于现阶段,主要就治疗肝细胞癌(HCC)、尿路上皮癌(UC)及胃癌(GC)开发核心候选产品。

招股书披露的和誉研发管线:


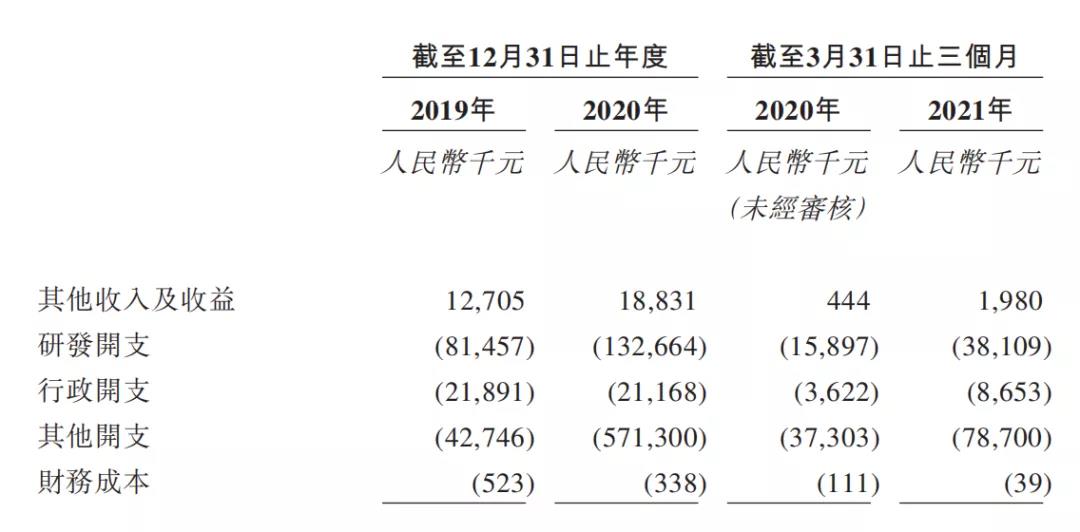
公司财务状况
2020年研发投入:1.32664亿
临床阶段候选药物
- ABSK011
已于中国内地启动ABSK011的Ib期临床试验,以评价ABSK011于治疗FGF19过表达晚期HCC患者时的安全性及有效性,并于2021年6月对首位病患给药。于2021年7月就ABSK011联合抗PD-L1抗体阿特珠单抗治疗FGF19过表达晚期HCC患者的II期研究提交IND申请,该研究为一项独立于上述Ib期试验的试验。罗氏将提供阿特珠单抗。ABSK011是核心候选产品之一,是一种有效的高选择性小分子成纤维细胞生长因子受主4(FGFR4)抑制剂,正在中国对其进行临床项目研究。ABSK011被开发用于治疗FGF19/FGFR4信号高度活化的晚期肝细胞癌(HCC)。已于台湾完成一项Ia期临床试验,确定ABSK011于治疗晚期实体瘤患者时的安全性、耐受性、药代动力学及最大耐受剂量(MTD)及╱或建议2期剂量(RP2D)。试验的初步数据表明ABSK011具有良好的安全性及良好的PK/PD特性。认为ABSK011具有治疗FGF19/FGFR4渠道高度活化的HCC患者的潜质。ABSK011针对一、二线治疗。根据ABSK011 II期临床试验的患者招募标准,仅招募从未接受过任何治疗或仅接受过一线治疗的HCC患者。
已于中国内地启动ABSK011的Ib期临床试验,以评价ABSK011于治疗FGF19过表达晚期HCC患者时的安全性及有效性,并于2021年6月对首位病患给药。于2021年7月就ABSK011联合抗PD-L1抗体阿特珠单抗治疗FGF19过表达晚期HCC患者的II期研究提交IND申请,该研究为一项独立于上述Ib期试验的试验。罗氏将提供阿特珠单抗。
- ABSK091(AZD4547)
ABSK091,前称为AZD4547,是核心候选产品之一,是一种分子靶向候选产品,是FGFR亚型1、2及3的高效及选择性抑制剂。ABSK091(AZD4547)具有化学结构,不同于其他具有类似抗肿瘤活性的FGFR抑制剂。在ABSK091(AZD4547)获得许可之前,阿斯利康于2009年开始进行AZD4547的临床试验并于2019年终止AZD4547的开发,在此期间其赞助及完成共计4项试验,包括两项I期试验及两项II期试验。2019年11月,与阿斯利康签订了独家许可协议,并获得了ABSK091(AZD4547)的开发、制造及商业化的全球权利。初步开发ABSK091(AZD4547)作为治疗伴有FGFR变异的尿路上皮癌的一线及二线治疗方案。根据II期临床试验的患者招募标准,所招募的患者接受过一线治疗(若干类型的化疗)或从未接受过化疗。
正在开发ABSK091(AZD4547),用于治疗多种实体瘤,包括但不限于尿路上皮癌、胃癌、胆管癌及肺癌。于2021年2月在台湾完成了ABSK091(AZD4547)的I期研究。2020年12月,对于ABSK091(AZD4547)治疗中国内地伴有FGFR2或FGFR3变异的尿路上皮癌患者及晚期实体瘤患者方面的Ib/II期临床试验,获得国家药监局的新药临床试验(IND)批准。正于中国内地启动ABSK091(AZD4547)在晚期实体瘤患者中的Ib期试验以及在中国内地的II期试验,以评价ABSK091(AZD4547)在伴有FGFR2或FGFR3变异的尿路上皮癌患者中的安全性及疗效。已开始Ib期试验的患者招募工作,预期将于2021年底前完成患者招募并获得初步结果。
- ABSK021
ABSK021是一种口服生物利用度好、选择性、有效的小分子CSF-1R抑制剂,正在开发用于治疗多种类型的肿瘤学及非肿瘤学适应症。在美国完成ABSK021用于治疗晚期实体瘤患者的Ia期临床试验。Ia期临床试验数据表明,ABSK021具有良好的安全性及耐受性。于美国及中国正在启动Ib期临床试验。Ib期试验是一项开放性、多中心试验,以评价ABSK021于治疗四种不同类型肿瘤(即TGCT、TNBC、肺癌及胰腺癌)时的安全性、耐受性、PK特性及抗肿瘤效力。
- ABSK081(mavorixafor)
ABSK081(mavorixafor)又称X4P-001,是一款潜在的CXCR4新型小分子拮抗剂,根据弗若斯特沙利文的数据,其是目前全球临床开发上唯一口服生物利用度好的CXCR4调节剂。ABSK081(mavorixafor)是多种癌症的潜在治疗方案,其中CXCR4及其配体CXCL12(也称为基质衍生因子1 alpha SDF-1α)有助于肿瘤微环境(TME),支持免疫逃避、新生血管生成及肿瘤转移。ABSK081(mavorixafor)也可用于治疗其他疾病,如疣、低丙种球蛋白血症、感染及骨髓粒细胞缺乏(WHIM)综合症。
在2019年7月,与X4 Pharmaceuticals,Inc.(「X4」)签订了独家许可协议,并就许可化合物ABSK081(mavorixafor)(前称为X4P-001)以及在中国内地、台湾、香港及澳门许可地区在人类任何肿瘤适应症及WHIM综合症的诊断、治疗、缓解或预防领域(不包括mozobil适应症以及任何用于自体HSCT治疗及异体HSCT治疗的任何用途)中含有此许可化合物的任何产品(「X4产品」),获得开发、制造及商业化的权利。在ABSK081(mavorixafor)获得许可之前,共有194名患者在X4赞助的10项临床研究中接受了ABSK081 mavorixafor治疗(n=70名健康志愿者,n=16名HIV患者,n=99名肿瘤学患者,n=9名WHIM综合症患者)。X4开展的WHIM II期X4P-001-MKKA研究表明,ABSK081(mavorixafor),400mg,每日一次,能调动WHIM综合症成人患者的中性粒细胞及淋巴细胞,为长期治疗的患者提供临床益处的初步证据。
X4目前正在进行在全球注册的WHIM综合症III期临床试验。已取得人体试验委员会批准,并已于2021年7月在中国启动ABSK081(mavorixafor)联合上海君实生物医药科技股份有限公司(「君实」)生产的特瑞普利单抗治疗TNBC患者的Ib/II期临床试验。
- ABSK043
ABSK043为一种口服生物利用度好、高选择性的小分子PD-L1抑制剂,正在开发用于治疗多种癌症及潜在非肿瘤适应症。尽管抗PD-1╱抗PD-L1抗体已彻底改变癌症治疗,但基于抗体的免疫疗法具有成本高昂、缺乏口服生物利用度及免疫原性等多项缺点,可能会被小分子抑制剂改善。ABSK043与PD-L1特异性结合,可能导致PD-L1二聚化及细胞表面内化。临床前数据已显示ABSK043可强效抑制PD-1/PD-L1的相互作用,并能挽救PD-L1介导的T细胞活化抑制。ABSK043在多个临床前模型中亦显示出强大的抗肿瘤疗效及卓越的安全性。已于2021年7月获得澳大利亚药物管理局(TGA)的监管批准,以启动ABSK043的I期临床试验。于2021年8月,于澳大利亚完成ABSK043的I期临床试验的首例患者给药。
选择性临床前阶段候选药物
除临床阶段资产外,还有十项临床前资产,该等药物专注于新靶点或作用方法,因此具有成为解决重大未满足医疗需求的新型潜质。以下为临床前阶段资产的标明清单,而计划于未来12至24个月就其提交IND申请:
- ABSK061
ABSK061是一种FGFR2/3抑制剂。其对FGFR1的选择性可能引致改善治疗窗口及疗效,以及更好的机会扩展到治疗非肿瘤适应症。的临床前研究表明,ABSK061通过各种生化及细胞试验选择性地抑制FGFR2/3(而非FGFR1),并且对其他激酶具有低活性。ABSK061在FGFR2/3依赖性异种移植模型中也显示出强靶点参与性。
ABSK061亦表现出跨物种的良好DMPK特性以及物理化学特性及安全性。目前正在开展ABSK061的临床前研究。
与主管部门的重大沟通
预期于2021年下半年提交IND申请。
- ABSK121
ABSK121是一种新一代FGFR1-3突变抑制剂,不仅抑制野生型FGFR,亦抑制FGFR变异(其对目前已获批准的FGFR抑制剂耐药)。它可能被用以治疗各种癌症适应症,包括尿路上皮癌、胆管癌及其他伴FGFR重排的实体瘤。其亦可能对第一代FGFR抑制剂初始治疗后复发或恶化的患者带来临床益处。
于临床前实验中,ABSK121于体外及细胞内对野生型FGFR1-4表现出优异的活性。其于临床上亦表现出对FGFR变异(对目前的FGFR抑制剂耐药)的强大效力。其于FGFR依赖性及FGFR变异依赖性模型中表现出良好的体内疗效。其于KinomeScan中对其他RTK表现出良好的选择性,口服生物利用度好及具有良好的DMPK特性及体外安全性。目前正在进行ABSK121的临床前研究。
- ABSK012
ABSK012是新一代小分子FGFR4抑制剂,对野生型及变异型FGFR4均有强抑制作用。使用第一代FGFR4抑制剂治疗后,FGFR4可能发生获得性变异并导致耐药性。在横纹肌肉瘤等肿瘤中也发现类似的耐药变异,并推动肿瘤的发展。在临床前研究中,ABSK012不仅在体外及细胞内对野生型FGFR4具有优异的活性,于临床开发中对各种FGFR4变异(对目前的FGFR4抑制剂耐药)亦具有优异的活性。其于FGF19推动及FGFR4变异模型中亦表现出良好的体内疗效。ABSK012具有强大的激酶选择性、良好的DMPK特性及体外安全性。目前正在进行ABSK012的临床前研究。
与主管部门的重大沟通
预期将于2022年提交IND申请。
- ABSK111
ABSK111是一种对EGFR外显子20变异高度有效的选择性小分子抑制剂。有3%至5%的NSCLC患者会发生EGFR外显子20变异,该变异对目前可用的第一代、第二代及第三代EGFR抑制剂具有耐药性。由于对野生型EGFR的选择性有限,目前针对该等变异的临床化合物的治疗窗口有限。在临床试验中,增加选择性将可能导致更好的靶向调节及疗效。于多项细胞试验中,ABSK111表现出对EGFR外显子20变异的优异活性及对野生型EGFR的明确选择性。其对携带EGFR外显子20变异的小鼠异种移植模型具有的疗效及PD作用。
目前正在优化导向化合物的物理化学及其他性质,并预计在不久的将来指定临床前候选药物。
- ABSK071
ABSK071是一种强效、口服生物利用度好、不可逆的小分子变异形式KRAS抑制剂,于生化及细胞环境中具有强大的效力。KRAS是许多癌症类型(包括胰腺癌、结肠癌及肺癌)中变异最多的肿瘤基因之一。由于其分子结构及对GTP的高亲和力,就小分子抑制剂而言,KRAS过往被认为不可成药。约30%的亟需有效治疗的肺癌患者会发生KRAS变异。
ABSK071于细胞增殖及靶向调节试验中均表现出对KRAS变异较强的体外活性。其亦表现出良好的ADME及理化特性。目前正在评价ABSK071的其他特性,并预期于不久的将来标明一种临床前候选药物。
- ABSK051
ABSK051是一种小分子CD73抑制剂。CD73在腺苷信号传导中起关键作用,并控制细胞外ATP连续转化为腺苷的最后一步(AMP的水解)。肿瘤微环境中产生的腺苷可抑制肿瘤免疫。CD73的抑制通过刺激抗肿瘤T细胞的活化而增强对癌细胞的适应性免疫。用小分子靶向CD73可以获得优势,特别是在实体瘤及联合治疗中。来自Arcus Bioscience的CD73小分子抑制剂AB680已在胰腺癌患者的临床试验中显示出初步疗效。
ABSK051于抑制可溶性及表面表达CD73的活性方面表现出强大的效力。其于多种动物模型中亦表现出较强的体内疗效。ABSK051已被标明为临床前候选药物。目前正在进行ABSK051的临床前研究。
- ABSK031
ABSK031是一种口服生物利用度好的小分子RORγt拮抗剂,于生化、细胞学报告及Th17分化实验中对RORγt信号传导有强效活性。于口服给药后,ABSK031已显示出其有潜质激活RORγt,并促进大鼠脾脏中的Th17细胞分化。于多种同基因肿瘤模型中,其作为单药治疗或联合抗PD-1抗体治疗亦表现出良好的抗肿瘤疗效。ABSK031亦表现出强大的PK、理化特性及安全性,适合进入下一阶段开发。
参考资料:
https://www1.hkexnews.hk/listedco/listconews/sehk/2021/0930/2021093000014_c.pdf




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论