
据药融云数据库显示:2023年2月23日,临床阶段生物制药公司Enliven Therapeutics宣布与生物技术公司Imara完成合并,合并后的公司将以Enliven Therapeutics的名义运营,其股票于次日在纳斯达克全球精选市场交易(NASDAQ:ELVN)。
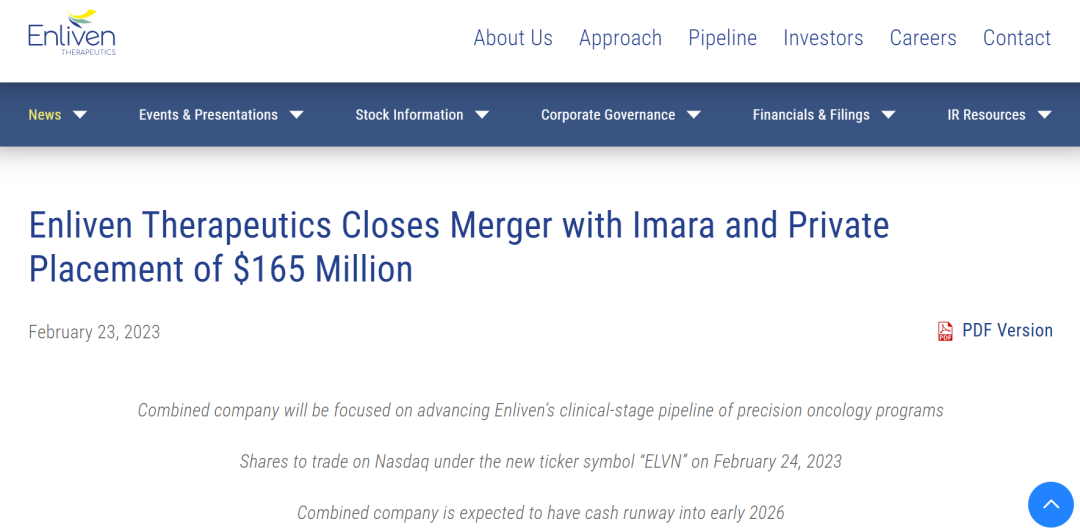
在合并的同时,Enliven完成了1.65亿美元的私募融资,由新投资者Fairmount和Venrock Healthcare Capital Partners共同领投,其他新投资者参与,包括Fidelity Management & Research Company,RA Capital Management,Frazier Life Sciences和Commodore Capital,以及Enliven所有现有机构投资者的支持。交易完成后,Enliven的现金流跑道延长到2026年,有望实现多个临床里程碑。此次合并完成后,Imara股东持有新公司约16%的股份,Enliven股东(包括私募投资者)持有约84%的股份。
药融云数据显示:如今的Enliven Therapeutics是一家精准肿瘤学公司,专注于发现和开发小分子抑制剂,以帮助癌症患者不仅活得更久,而且活得更好。
截图自药融云数据库
Enliven Therapeutics组建了一支经验丰富的猎药人团队,在发现和开发小分子激酶抑制剂方面具有丰富的专业知识,团队中包括20多种临床候选分子的主要或共同发明人,其中4款获FDA批准;以及领导或参与过60多个小分子激酶抑制剂项目的发现、开发或商业化的精准肿瘤学和激酶抑制剂专家。

研发管线
Enliven通过将临床验证的靶点和特定的耙点产品组合与严格的临床试验设计和监管策略相结合,目标是开发具有更高临床成功概率的药物。
目前Enliven Therapeutics正在平行推进两个候选产品。

ELVN-001是一种强效、高选择性小分子激酶抑制剂,旨在特异性靶向断裂点簇集区Abelson白血病病毒(BCR-ABL)融合基因,这是慢性髓系白血病(CML)患者的致癌驱动因素。
尽管BCR-ABL酪氨酸激酶抑制剂(TKIs,例如伊马替尼)的批准显著提高了CML患者的预期寿命,但随着患者治疗时间延长,对生活质量的影响和治疗的耐受性逐渐成为重要的考虑因素。目前市场上绝大多数活性位点TKIs都具有脱靶活性,导致治疗相关的不良事件(AEs)和由于不耐受或耐药性而停药。据统计,有大约20%的患者在治疗的第1年内改变治疗方案,大约40%的患者在治疗的前5年内改变治疗方案,三线治疗及以上患者群体数量逐渐增长(占慢性CML患者的25%以上),但治疗选择有限。77%的医疗专业人员认为需要更有效、更安全、更可耐受的CML药物。
在临床前研究中,ELVN-001与某些领先的和研究性疗法相比,已被证明有更好的基因组选择性、耐受性和强大的肿瘤生长抑制作用。此外,该药物对T315I突变具有高活性,该突变对几乎所有已批准的TKIs都具有抗性。作为一种选择性活性位点抑制剂,ELVN-001的作用机制可能是变构BCR-ABL抑制剂,如第四代BCR-ABL酪氨酸激酶抑制剂Scemblix(Asciminib)的补充选择,这可能在CML的标准治疗方案中发挥越来越重要的作用。

另外,ELVN-001有可能成为对共病患者更有吸引力的一个选择,这些患者希望在严格的用药方案之外获得一些伴随用药方案和更多的用药自由度。ELVN-001目前正在慢性髓系白血病(CML)患者中进行1期临床试验。
2024年4月11日,Enliven Therapeutics宣布了评估ELVN-001在复发、难治或对现有酪氨酸激酶抑制剂(TKIs)不耐受的慢性髓系白血病(CML)患者中的1期临床试验的积极概念验证数据。
截至2024年3月18日,44%(7/16)的可评估反应患者在第12周达到累积主要分子学反应(MMR)率,既往使用过Asciminib和/或TKI耐药的患者也表现出40%的反应率。

在可评估反应的患者中,所有患者在12周时BCR::ABL1转录水平都有改善或稳定。安全性方面,ELVN-001耐受性良好,无3级或更高级别的非血液学治疗相关不良事件(TRAE),也没有剂量减少的报告。

这些数据与先前批准的BCR::ABL1 TKI的1期研究的累积MMR率相比具有优势,特别是考虑到该研究的反应评估时间更短,以及许多患者先前接受过多线治疗。

另外,药代动力学数据支持ELVN-001每日一次给药,具有灵活的给药要求(无显著的食物影响,药物与药物相互作用的风险极小)。值得一提的是,鉴于已批准的BCR::ABL1 TKI的靶点覆盖率与一线治疗疗效之间的强相关性,ELVN-001的剂量等于或大于40mg QD时,与第二代活性位点TKI相比,实现了更优的靶点覆盖率;ELVN-001的剂量为80mg QD时,实现了与Asciminib相似的靶点覆盖率。
消息公布当日,Enliven Therapeutics股价大涨20.18%。根据该公司披露,1b期数据预计将于2025年公布,预计将包括约60-100名接受过不同疗法的患者,并进行大量随访。2025年年底计划进行初步的监管互动,目的是明确首次头对头关键试验的监管路径。

截图自雪球
Enliven Therapeutics的第二款候选产品ELVN-002是一种有效的、高选择性的、中枢神经系统渗透性和不可逆的HER2抑制剂,具有抗野生型HER2和各种HER2突变的活性。
该候选药物旨在最大限度地抑制HER2,并实现合理的联合治疗,特别是对于HER2+癌症。该公司认为,Enhertu®(德曲妥珠单抗)颠覆了HER2突变肿瘤的现有治疗模式,对这种新的治疗方案有疾病进展或不耐受的患者又引出了新的未满足治疗需求,因此ELVN-002在HER2扩增和/或过表达的NSCLC(非小细胞肺癌)、CRC(结直肠癌)和MBC(转移性乳腺癌)治疗领域拥有潜在机会。
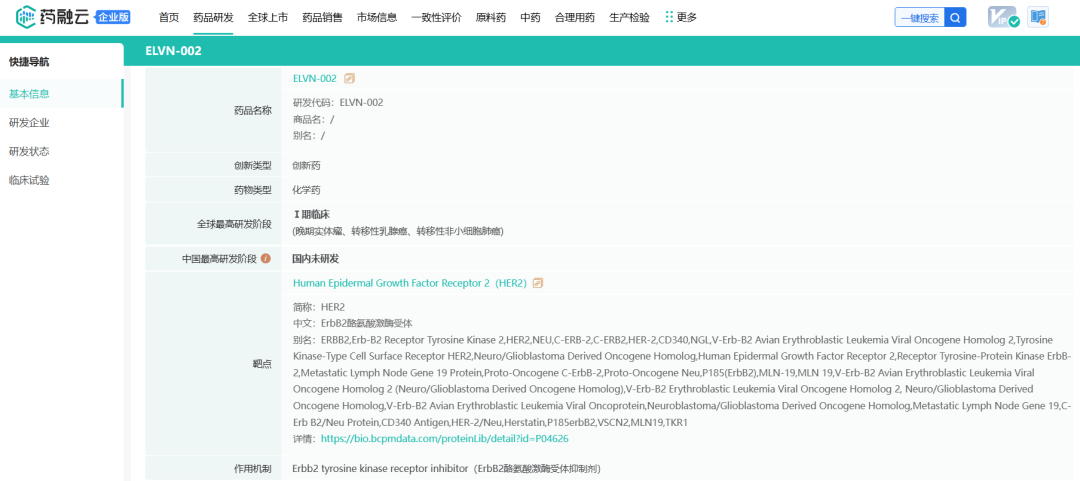
截图自药融云数据库
美国FDA已批准ELVN-002的IND申请,Enliven Therapeutics启动了第一个研究中心,以评估ELVN-002与曲妥珠单抗+/-化疗药物联合治疗HER2+转移性乳腺癌(MBC)和结直肠癌(CRC)成人患者的疗效。联合治疗研究的首例患者给药计划于2024年第二季度进行。
ELVN-002针对HER2+癌症患者的联合试验得到了正在进行的单药治疗试验的初步数据的支持,其中包括:研究者报告了HER2+和HER2突变肿瘤的反应(包括未经证实),包括使用Enhertu®(德曲妥珠单抗)治疗后疾病进展的患者和脑转移患者,剂量耐受性良好。
重要的是,在临床预测的最佳单药治疗剂量下,ELVN-002基于癌症患者的药代动力学和临床前HER2+疗效,与口服小分子HER2蛋白的酪氨酸激酶抑制剂(TKI)图卡替尼相比,其靶点覆盖率提高了10倍以上。
预计Enliven Therapeutics将于2025年公布ELVN-002的1期单药治疗数据、HER2+ CRC的1a/b期赫赛汀联合疗法数据以及HER2+ MBC的初始1a期联合疗法数据。
财务状况
2024年3月19日,Enliven Therapeutics宣布获得9000万美元的私募股权融资,新老投资者包括Commodore Capital、Fairmount、Venrock Healthcare Capital Partners、一位生物技术投资者、一个大型共同基金、Rock Springs Capital、Logos Capital、Woodline Partners LP和Acuta Capital Partners。融资完成之后,截至2024年3月31日,该公司拥有总计3.205亿美元的现金、现金等价物和有价证券,预计现金流跑道将延长至2026年底。该公司累计赤字为1.772亿美元。
Enliven Therapeutics公司2023全年研发费用为6460万美元,而2022年全年为3100万美元;一般和行政(G&A)费用为1900万美元,2022年全年为780万美元;2023年全年净亏损总额为7160万美元,而2022年全年为3770万美元。
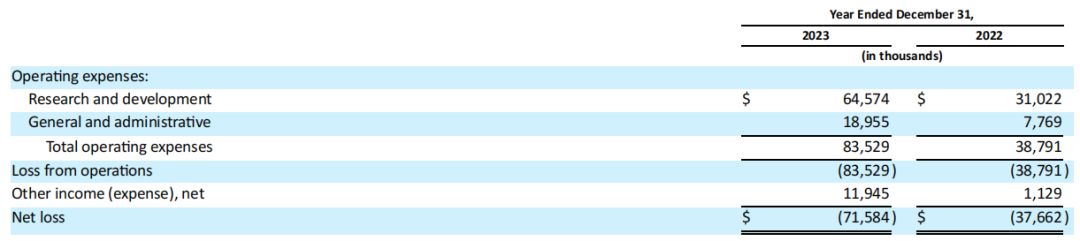
2024年第一季度,该公司研发费用为2000万美元,去年同期为1190万美元;一般和行政费用为600万美元,去年同期为450万美元;2024年第一季度净亏损2270万美元,去年同期为1470万美元。

以下为Enliven Therapeutics股东情况(截至2024年4月8日):
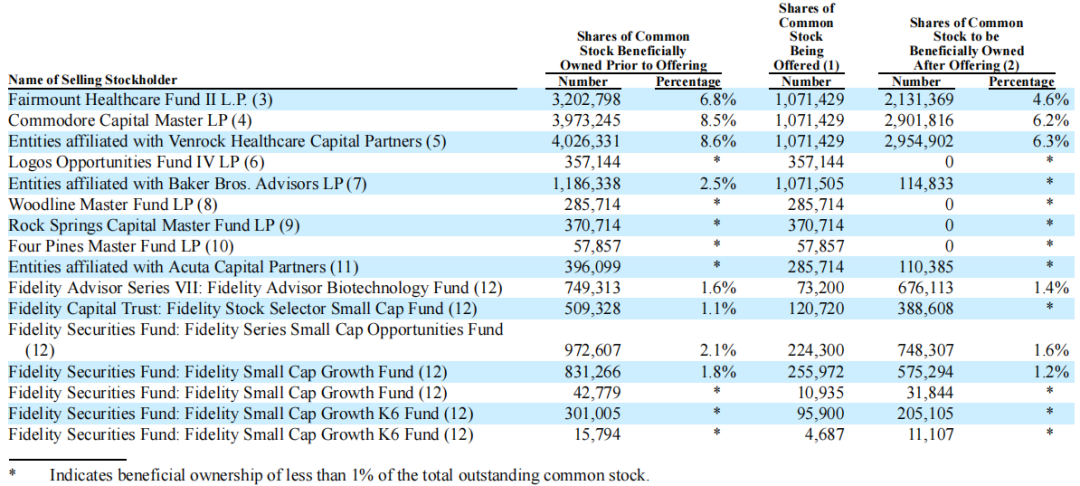
截至2024年6月25日,Enliven Therapeutics公司市值约为10.3亿美元。截止发文前,市值为11.59亿美元,每股24.65美元。
美国“生物安全法案”事件影响
鉴于目前Enliven Therapeutics没有任何制造设施,该公司依赖第三方制造和生产候选药物。根据Enliven财报,康龙化成为该公司提供原料药,且是临床前研究和临床研究的合作方。Endpoints今年4月报道,指出美国“生物安全法案”事件可能会波及到更多中国的医药外包公司,Enliven Therapeutics在该文中表示,若与康龙化成的合作被限制,Enliven的一款针对癌症的小分子激酶抑制剂的研发和生产可能会被迫中止。如果中美相关政策发生变化,Enliven可能会面临产品供应中断和成本增加的风险。
不管美国所谓此类安全法是否通过,地缘zz已经不可避免。影响互相之间合作的信心。不过,中国企业的高质量/快速的服务,想必仍然能获取不少制药企业信任。
参考来源:
[1] CDE/NMPA官网
[2] 药融云数据库
[3] FDA/EMA/PMDA
[4] 相关公司公开披露(正文图片均来自企业官方,除非另有说明)
https://www.enliventherapeutics.com/;
https://www.globenewswire.com/news-release/2023/02/23/2614889/0/en/Enliven-Therapeutics-Closes-Merger-with-Imara-and-Private-Placement-of-165-Million.html;
https://endpts.com/us-china-tensions-threaten-to-ensnare-additional-chinese-biopharma-contractors/;
https://www.globenewswire.com/news-release/2023/02/23/2614889/0/en/Enliven-Therapeutics-Closes-Merger-with-Imara-and-Private-Placement-of-165-Million.html;等等。
*此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场,不作任何用药推荐。
<END>
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论