
2024年3月19日,美国食品药品监督管理局(FDA)宣布批准Idorsia Pharmaceuticals公司研发的新分子实体药物Tryvio(有效成分:Aprocitentan)上市。Tryvio是一种内皮素受体拮抗剂,用于治疗与其他降压药联用仍不能充分控制的高血压。Tryvio是目前首款也是唯一一款内皮素受体拮抗剂,是近30多年来首个获批的通过新治疗途径发挥作用的口服抗高血压疗法。
高血压全球概况及临床常用药物
高血压是指血管压力过高(140/90mmHg或更高),其发病率持续上升。根据最近的一项研究,在过去40年中,受高血压影响的人数几乎翻了一番,全球约有11.3亿人患有高血压。据世界卫生组织估计,高血压每年导致750万人死亡,约占全球死亡总人数的12.8%。
高血压通常是在没有明显症状的情况下经过多年发展而成的,如果不及时治疗可能会带来脑卒中、失明、心力衰竭、肾衰竭、性功能障碍等严重并发症。临床上常用以下6类治疗高血压药物单用或联用治疗高血压:
1.利尿剂,以肾脏为目标,帮助人体排出钠和水,从而降低血容量。
2.α受体拮抗剂,能阻止去甲肾上腺素或肾上腺素收缩血管作用,从而改善血流并降低血压。
3.β受体拮抗剂,可以阻断肾上腺素的作用,使心脏跳动更慢,力量更小,并改善血液流动,从而降低血压。
4.血管紧张素转换酶(ACE)抑制剂,能阻止血管紧张素II的形成,而血管紧张素II是一种能使血管变窄的物质,因此能降低血压。
5.血管紧张素II受体(ARB)拮抗剂,可以阻断血管紧张素II的作用而非形成。ACE和ARB抑制剂通常都是慢性肾病患者的治疗方法之一。
6.钙老离子通道阻滞剂,通过阻止钙进入肌肉细胞,减少心脏内的电传导。这会降低肌肉细胞的收缩力,扩张动脉,从而降低血压。
Tryvio(Aprocitentan)治疗优势
如果使用三种不同类别的抗高血压药物(包括利尿剂)联合治疗仍无法降低高血压,则被称为难治性高血压。近年来,尽管开发出了许多新的降压疗法,但上一次批准通过新的降压机制途径发挥作用的降压药物已经是30多年前的事了。Tryvio是近30多年来首个获批的通过新治疗途径发挥作用的口服抗难治性高血压疗法,在Tryvio获得批准之前,尚无其他FDA批准的针对ET通路的全身性抗高血压疗法。
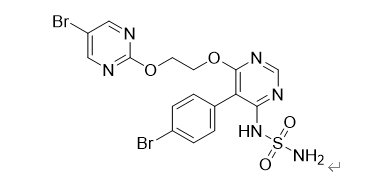
图1 Aprocitentan结构
Tryvio的有效成分为Aprocitentan,可抑制内皮素-1(ET-1)与内皮素受体A(ETA)和内皮素受体B(ETB)受体的结合。ET-1及其受体在血管内皮和血管平滑肌细胞中高表达,对血流动力学动态平衡起重要的调节作用。ET-1是包含21个氨基酸的肽类,能够不可逆地与其受体结合,是目前最强的、持续时间最长的血管收缩剂。在高血压中,ET-1还可导致内皮功能障碍、血管肥大和重塑、交感神经激活和醛固酮合成增加。由于内皮素和内皮素受体相互作用的存在,可能是目前现有药物无法控制血压的原因之一。
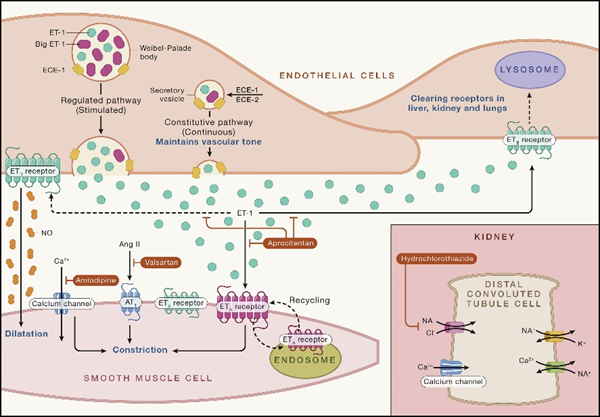
图2 内皮素及其内皮素受体作用通路
FDA批准Tryvio上市依据
此次FDA的批准是基于Tryvio的一项III期PRECISION试验结果,该研究通过三个阶段研究分析了Tryvio对730名难以控制高血压患者的短期和长期疗效。第一阶段是为期4周的双盲期,其中730例患者被随机分配至12.5mg(n=243)、25mg(n=243)Aprocitentan组或安慰剂组(n=244);第二阶段是为期32周(4~36周)的单盲期,患者接受25mg的Aprocitentan(n=704)治疗;第三阶段是为期12周(36~48周)的双盲停药期,患者按1:1重新随机分配至25mgAprocitentan组(n=307)或安慰剂组(n=307)。
结果显示,Tryvio达到了试验的主要疗效终点,即服药四周后,与安慰剂组相比,Tryvio可以显著降低患者的坐位收缩压(SBP)。同时Tryvio也达到了试验的关键次要疗效终点,即在第36~40周期间,接受Aprocitentan治疗的患者的坐位收缩压较安慰剂组持续降低,在第40周时,与25mgAprocitentan相比,安慰剂组患者的坐位收缩压上升了+5.8mmHg。
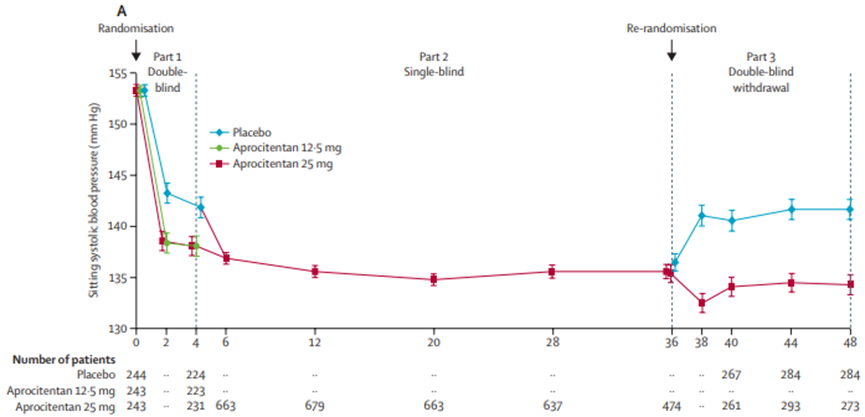
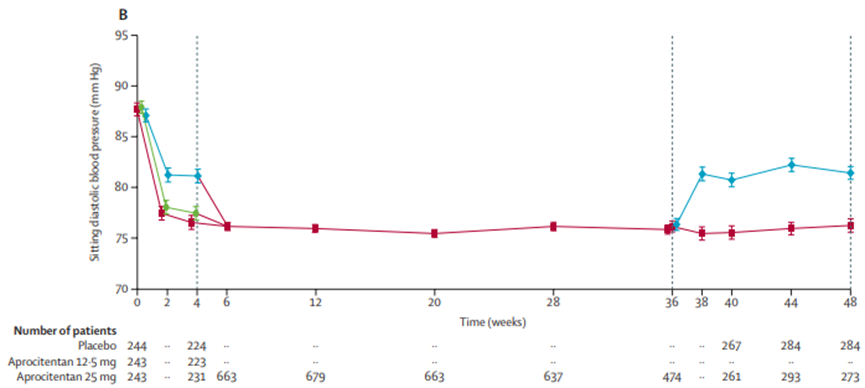
图3 坐位收缩压和舒张压随时间变化试验结果
Tryvio临床历程
Tryvio的批准背后经历了长达数年的临床前和临床研究,在全国各地完成了Tryvio安全性和有效性研究,对Tryvio在健康受试者和患有肝损伤患者中药代动力学和代谢性进行了评价,评估了Tryvio与其他药物联用的治疗效果和药物相互作用研究。一项发表在《柳叶刀》期刊上的III期临床试验的积极结果成为Tryvio成功上市的催化剂,Idorsia公司于2022年12月19日向FDA递交Tryvio的新药上市申请,经FDA统一审查后,于2024年3月19日成功获FDA批准上市。下图总结了Tryvio在不同阶段临床试验的研究历程。
图4 Tryvio临床历程

总结
Idorsia美国公司总裁兼总经理Tosh Butt评论说:“Tryvio在美国获得批准是Idorsia公司的又一个重要里程碑。通过Tryvio,我们获得了一种在全身性高血压领域具有独特作用模式的创新药物。”多年来批准的高血压药物侧重于盐水平衡调节、肾素-血管紧张素-醛固酮系统的拮抗作用、降低细胞外钙离子流入细胞、交感神经活性或非选择性血管舒张作用,尚没有一款针对内皮素通路的全身性抗高血压疗法,Tryvio的获批填补了这一空白,为高血压患者带来了新的治疗模式。
参考资料:
[1]FDA官网:https://www.fda.gov/
[2]Idorsia官网:https://www.idorsia.com/
[3]Schlaich MP, et al. Dual endothelin antagonist aprocitentan for resistant hypertension (PRECISION): a multicentre, blinded, randomised, parallel-group, phase 3 trial. Lancet. 2023 Jan 28;401(10373):268
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论