
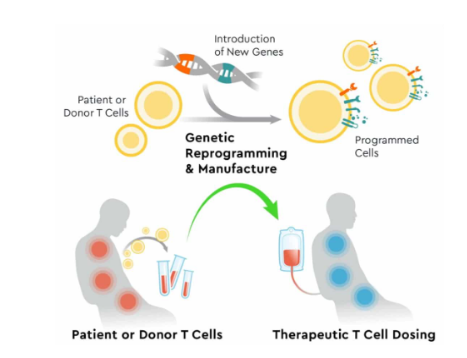
CAR-T细胞治疗,通过白细胞单采术采集癌症患者的T细胞,通过基因工程技术改造、加工、培养 T 细胞,并将扩增好的CAR-T 细胞回输至患者体内。整个过程大约需要3-4周。
具体而言,包括 5 个步骤:通过单采或外周静脉血收集外周血单核细胞(PBMC)——T 细胞分选和活化——使用病毒(一般为慢病毒载体或逆转录病毒载体)或非病毒载体进行CAR 结构改造——体外 CAR-T 细胞扩增——末端工艺和冷冻保存。

近日,一家T细胞疗法开发商Kyverna Therapeutics在BioRxiv上发表了一篇论文,表示Kyverna 创造了一种新型CAR-T细胞疗法生产工艺,这种名为“Ingenui-T”的技术只需不到300ml的全血,而不是单采。
Ingenui-T是一种专有的、处于临床前开发阶段的下一代工艺,用于制造自体抗CD19 CAR-T 细胞疗法。与冷冻保存的白细胞单采的CAR-T 细胞相比,使用 Ingenui-T 进行最小体外扩增的新鲜全血制造的抗 CD19 CAR-T 细胞表现出相当或更好的CAR受体介导和对CD19靶标的杀伤增强。
抗 CD19 CAR-T 细胞是使用 Ingenui-T 在不到 3 天的体外培养中从全血中生产出来的,每 100 mL 平均产生约 4000 万个细胞, CD3 具有高纯度和高活力。
Ingenui-T是一种创新的静脉对静脉解决方案,旨在通过提供一种侵入性更低的血液分离替代方案来提升CAR - T细胞疗法患者的治疗体验,并通过静脉到静脉方式将CAR - T细胞治疗过程最小化,大幅降低成本。

Karen Walker
Kyverna首席技术官Karen Walker说:“我们能够在不影响操作质量或最终产品特性的情况下实现CAR - T细胞生产过程最小化。”
KYV-101
Kyverna的核心管线是自体抗CD19 CAR-T 细胞疗法KYV-101,前不久,KYV-101获得美国FDA授予快速通道资格,用于多发性硬化症。目前,KYV-101已获得七个FDA IND进行相应的临床试验。
KYV-101适应症查询

截图来源:药融云全球药物研发数据库
关于Kyverna Therapeutics
Kyverna Therapeutics成立于2018年,是一家处于临床阶段的细胞治疗公司,聚焦开发自免疾病的CAR-T疗法,研发管线包括CD19 CAR-T,用于治疗狼疮肾炎、系统性硬化症、重症肌无力、多发性硬化症,以及治疗炎症性肠病的CAR-T疗法等。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论