
昨日,贝海生物宣布其研发用于治疗乳腺癌、非小细胞肺癌、前列腺癌、胃癌的创新药物BH009已向美国FDA递交了新药上市申请(NDA),已被FDA受理并进入正式审评阶段。据悉,BH009是贝海生物自主开发的具有明显临床优势的多西他赛改良型新药。
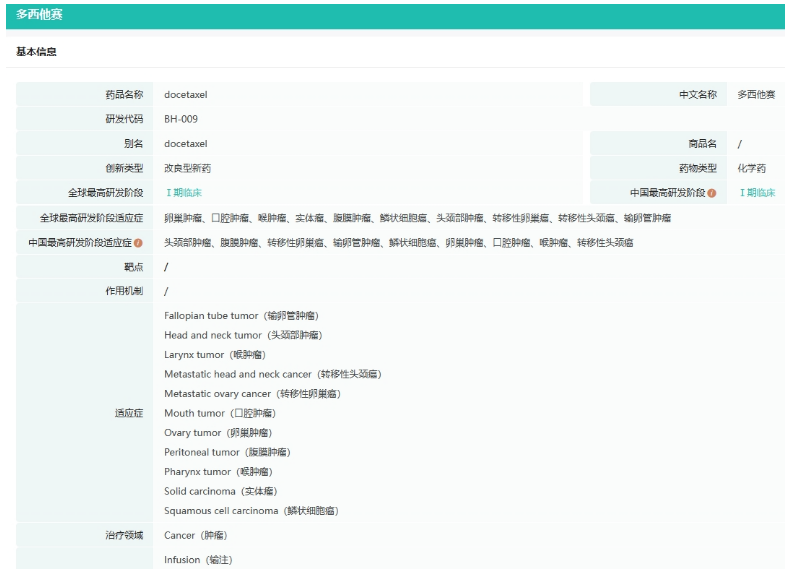
截图来源:药融云全球药物研发数据库
BH009是贝海生物自主开发的具有明显临床优势的多西他赛创新产品,目前全球尚无同类产品上市。多西他赛上市26年来,由于其临床使用的广泛性和不良毒副反应的明显问题并存,吸引了全球众多公司试图解决其存在的临床问题,开发更有市场潜力的新品种。但由于多西他赛剂型的特殊性,改良难度高,目前全球尚无进展到临床后期阶段的产品。BH009填补了这一领域的空白,是全球首个在关键性临床中成功达到终点的多西他赛改良型新药。

截图来源:药融云全球药物研发数据库
在2023年美国临床肿瘤学会(ASCO)年会上,贝海生物首次发表了BH009在晚期实体瘤患者中的临床研究结果(e13002)。研究表明BH009能明显改善现有多西他赛产品中吐温80引起的严重毒副作用,大大提高了临床安全性,满足了患者亟待解决的临床需求。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论