
近日,BioMarin Pharmaceutical 宣布与德国国家法定医疗保险基金协会(GKV-SV)达成一项为期三年的新协议,为重度血友病a患者提供Roctavian (valoccogene roxaparvovec-rvox)基因疗法的报销。GKV-SV覆盖了约90%的德国人口,德国是欧洲最大的市场。这家总部位于加州的公司表示,其一次性单剂量治疗药物通过静脉注射三到四个小时,在德国的总价格为每瓶28,933.53欧元(约合31,780美元)。固定定价成为欧洲私人保险公司和其他医疗机构的参考点。
Roctavian药物基本信息

截图来源:药融云全球药物研发数据库
Biomarin估计,根据平均患者体重和一次性治疗所需的瓶数,再加上折扣,估算每年每位患者花费约为90万美元。

2023年6月,Biomarin宣布A型血友病基因疗法Valoctocogene roxaparvovec(商品名为Roctavian)获得FDA批准上市。此前,该产品已于2022年8月获得欧盟批准上市。Roctavian为全球首款A型血友病基因疗法,今年7月,据媒体报道,Roctavian在美国的定价为290万美元,要高于在欧洲的定价150万欧元。
SVB证券分析师当时预计,Roctavian年销售峰值约为22亿美元。此外2022年FDA批准了Hemgenix基因疗法,它是第一个治疗不太常见的B型血友病的基因疗法。它是由荷兰生物技术公司unique开发的,由CSL Behring公司在美国销售,标价为350万美元,刷新“全球最贵药物”的记录。
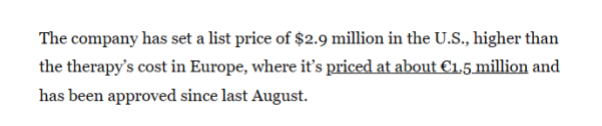
Roctavian是一种单次治疗药物,通过静脉输送三到四个小时。现有的替代方案包括患者终生定期输血或每月服用罗氏抗体药物Hemlibra,Hemlibra的标价约为50万美元。
虽然德国的报销价格低于预期,但可以使Roctavian成为欧洲潜在重要产品一位证券分析师表示。
BioMarin Pharmaceutical 2023年Q3财报显示:2023前三季总收入17.73亿美元,同比增长14%,现金及现金等价物16.74亿美元。2023前三季公司的前三大产品销售情况如下:


Vimizim前三季营收5.12亿美元,同比增长3%。该药物于2014年2月获得FDA批准,用于治疗粘多糖贮积症IVA型(Morquio A综合征),Vimizim是美国FDA批准的首个Morquio A综合征治疗药物。2019年6月Vimizim(中文商品名:唯铭赞)在中国获批,该药是国内首个黏多糖贮积症治疗药物。
Voxzogo前三季营收3.24亿美元,同比增长217%。增长迅速的原因是药物在2021年底和2022年初获得监管部门批准,全球市场持续扩张和患者的快速接受。2021年,美国FDA批准Voxzogo注射液上市,用于治疗5岁及以上骨骺(生长板)“开放”的软骨发育不全的儿童患者。Voxzogo是一款C型利钠肽类似物,它可通过阻断FGFR3的活性,直接靶向软骨发育不全的潜在病理生理学,从而促进软骨内骨形成,让患儿的生长速率恢复正常。
Naglazyme前三季营收3.22亿美元,同比下降6%。该药物于2005年获批上市,用于治疗粘多糖增多症VI (MPS VI)。MPS VI一种罕见的遗传代谢疾病,该病幼年即开始发作,患者表现为生长迟缓、身体组织受损和智力障碍。该疾病由于体内缺乏N-乙酰半乳糖胺-4-硫酸酯酶所引起的。Naglazyme通过酶替代疗法能够有效的缓解症状。
总结
8月30日,Biomarin在欧洲完成首例商业化基因疗法ROCTAVIAN患者治疗,未来公司业绩增长取决了该疗法在欧美市场的销量情况。据药融云数据库,在国内方面,A型血友病AAV基因疗法已经申报临床的有华毅乐健、信念医药等公司。B型血友病基因疗法方面,至善唯新、天泽云泰和信念医药等公司已经布局。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论