
11月27日,GSK公布了DREAMM-7头对头Ⅲ期试验的中期疗效分析结果,该试验评估了belantamab mafodotin(Blenrep)作为复发或难治性多发性骨髓瘤的二线治疗疗效。
结果显示,该试验达到了无进展生存期(PFS)的主要终点,并表明与现有的复发/难治性多发性骨髓瘤治疗标准daratumumab+BorDex相比,belantamab mafodotin联合硼替佐米+地塞米松( BorDex )可显著延长疾病进展或死亡的时间。在本次分析时也观察到了p值< 0.0005的具有显著临床意义的总生存期(OS)趋势,试验将继续对OS进行随访。
belantamab mafodotin药物基本信息
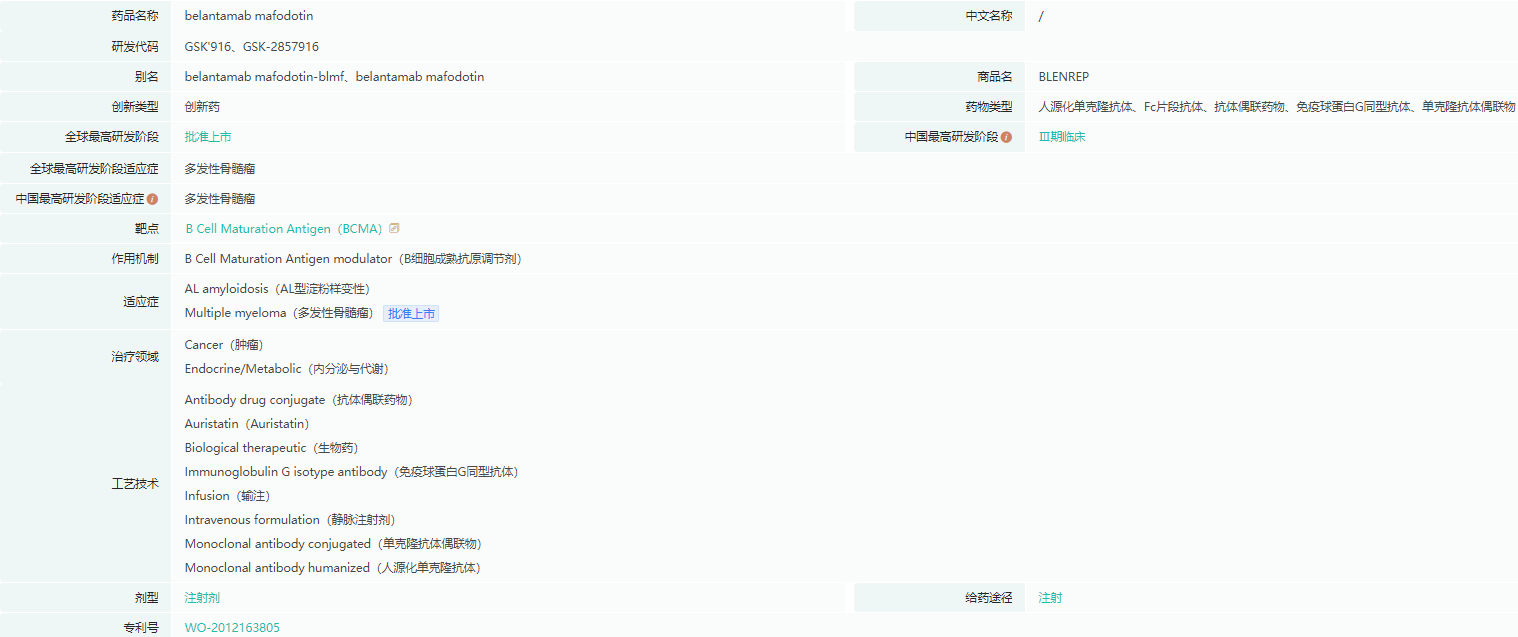
截图来源:药融云全球药物研发数据库

葛兰素史克公司高级副总裁、全球肿瘤研发负责人Hesham Abdullah说:“多发性骨髓瘤患者在首次复发后需要疗效好、容易获得且作用机制新颖的治疗方案。考虑到与基于达拉单抗的标准治疗方案的头对头比较,我们对belantamab mafodotin与BorDex联合治疗复发/难治性多发性骨髓瘤的潜力感到特别鼓舞。”
DREAMM(DRiving Excellence in Approaches to Multiple Myeloma)临床开发计划将继续评估belantamab mafodotin 在早期治疗以及与新型疗法和标准疗法联合使用方面的潜力。这包括正在进行的头对头Ⅲ期DREAMM-8试验评估belantamab mafodotin联合泊马度胺和地塞米松对比硼替佐米联合泊马度胺和地塞米松。预计DREAMM-8试验数据将在2024年下半年发布。
Blenrep是一种抗体-药物结合蛋白,它能寻找并结合BCMA蛋白,BCMA蛋白对浆细胞的生存至关重要,骨髓瘤细胞也表达这种蛋白。这种靶向机制使 Blenrep 能够将具有细胞毒性的 auristatin F 有效载荷特异性地传递给癌细胞。
2022年11月7日,在一项用于评估单药 Belantamab与Pomalidomide联合低剂量地塞米松 (Pom-Dex) 相比对复发/难治性多发性骨髓瘤 (RRMM)疗效的DREAMM-3实验中,Blenrep没有达到存活期的主要终点。与泊马度胺加地塞米松相比,Blenrep单药治疗未能显著提高无进展生存期。几周后,葛兰素史克应美国食品药品管理局的要求,从美国市场撤下了Blenrep。
相比之下,如今Blenrep在DREAMM-8试验中获得成功,可谓是起死回生。
参考:
药融云数据库
公司官网
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论