
2023年3月,中国国家药品监督管理局(NMPA)批准阿斯利康(AstraZeneca)研发的BTK抑制剂阿可替尼胶囊(acalabrutinib,商品名:Calquence/康可期)首次上市。用于治疗既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者;本次为附条件批准上市。
截图来源:药融云全球药物研发数据库
MCL是一种少见的非霍奇金淋巴瘤(NHL),临床上通常具有侵袭性,占中国所有NHL病例的2-6%。患者年龄通常在60岁左右,且确诊时通常已是疾病晚期。由于患者多数为老年人,不能耐受传统化疗的毒性,且尽管MCL患者对初始治疗敏感,但复发率很高,因此BTK抑制剂已成为MCL二线及以后治疗的首选方案。
2023年8月,单药适用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者,本品的第2项适应症在中国获批。
Acalabrutinib是新一代BTK选择性抑制剂,通过与BTK共价结合抑制其活性。在B细胞中,BTK信号导致B细胞增殖、转运、趋化和粘附所需的途径激活。本品曾获得美国FDA授予优先审评资格、突破性疗法认定和孤儿药资格。2017年,获得FDA的加速批准,用于治疗二线套细胞淋巴瘤(MCL)。后被批准用于初始疗法或后续疗法治疗慢性淋巴性白血病(CLL)或小细胞淋巴瘤(SLL)成人患者。
据药融云数据库显示:2022年度,本品业绩达20.57亿美元,同比增长69%。2923年前3季度,本品业绩为18.39亿美元,同比增加26%。
2016年,阿斯利康先斥资40亿美元收购Acerta Pharma 55%股权获得。分子最早由Organon开发,后辗转于先灵葆雅、默沙东;后到了新公司Acerta Pharma,命名代号为 ACP-196(寓意Aspire Covalution Pharma-196)相关专利:WO2013010868。
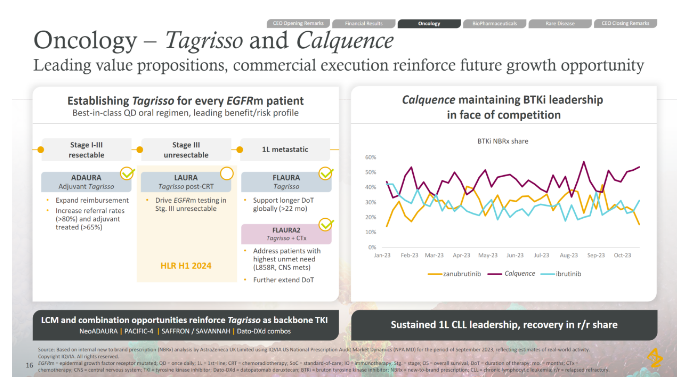
图 | AZ 2023Q3 PPT
3月份首次acalabrutinib在中国获批,是基于既往至少接受过一种治疗的MCL成人患者的全球临床研究ACE-LY-004,以及针对既往至少接受过一种治疗的MCL和其他B细胞恶性肿瘤患者的中国I/II期临床研究的研究结果。该适应症的常规批准将取决于正在开展中的确证性随机对照临床试验结果。
ACE-LY-004研究是一项开放的全球多中心II期单臂研究,入组124例既往至少接受过一种治疗的MCL成人患者。2020年第62届美国血液学会 (ASH) 年会和博览会上公布的38.1个月时的长期随访结果显示,研究者评估的总缓解率 (ORR) 为81%,48%的患者达到完全缓解 (CR)。接受阿可替尼治疗的患者的中位无进展生存期(PFS)为22个月。在最终数据截止时,中位总生存期 (OS) 达到59.2个月,安全性和耐受性与初始研究结果保持一致,脱靶效应相关不良事件风险较低,总体安全性良好。
据药融云数据库显示:4月份,“一项Acalabrutinib(ACP-196)与Venetoclax联合治疗加或不加阿托珠单抗与研究者选择的化学免疫疗法相比用于既往未接受过治疗的无del(17p)或TP53突变的慢性淋巴细胞白血病受试者的随机、多中心、开放性、3期研究,用以比较其疗效和安全性”开始在中国进行。

2023年初,Nathan Vardi出版了《For blood and money》/《救命求财》一书,关于Pharmacyclics和Acrta Pharma的传奇传记。本书即是回顾2009年至2017年这段时间的BTKi新药开发竞赛历史。Acrta Pharma 一开始从OSI Pharmaceuticals购买相关专利(225000美元)为acalabrutinib的开发和转手奠定了基础,堪称精彩。
参考:
NMPA/CDE;
药融云数据库;
FDA/EMA/PMDA;
相关公司公开披露;
阿斯利康;
中国抗癌协会血液肿瘤专业委员会, 中华医学会血液学分会, 中国临床肿瘤学会淋巴瘤专家委员会. 套细胞淋巴瘤诊断与治疗中国指南(2022年版) [J] . 中华血液学杂志, 2022, 43(7) : 529-536;等等。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论