
据CDE官网显示,阿斯利康递交的1类新药AKT抑制剂Capivasertib片的上市申请今日获受理。目前,全球尚无AKT靶向药物获批上市;今年6月,该药物的上市申请已获FDA受理并被授予优先审评资格。
截图来源:CDE官网
Capivasertib是三种AKT亚型(AKT1/2/3)的高效选择性抑制剂。AKT,也称为磷酸激酶B (PKB),在涉及细胞生长和分裂、细胞凋亡抑制和血管生成的多种级联信号传导机制中发挥着关键作用。AKT信号通路的激活,包括PIK3CA、AKT1和PTEN的改变,可出现在许多HR+/HER2-的晚期乳腺癌患者中,但也可能出现在没有这些基因改变的患者中。
Capivasertib基本信息(截至2023.10.09)

截图来源:药融云全球药物研发数据库
早在今年6月12日,阿斯利康便宣布,FDA已受理Capivasertib联合Faslodex(氟维司群)的新药申请(NDA),同时被授予了优先审评资格,用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。据悉,FDA将在今年第四季度做出审评决定。这也意味着AKT靶点在经历了40多年的艰难探索后终于迎来曙光。

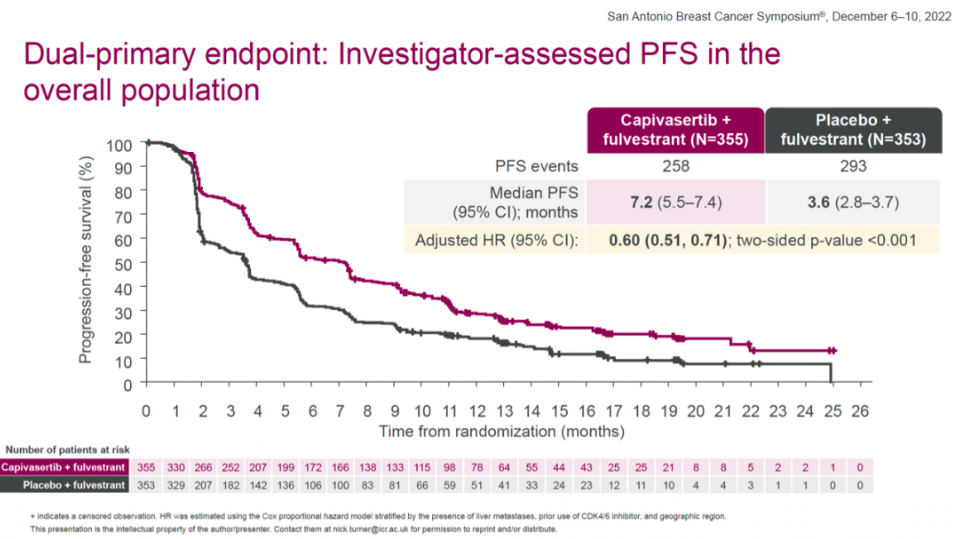
该项NDA是基于一项代号为CAPItello-291的III期试验数据。研究共纳入708例HR+/HER2-晚期乳腺癌患者,这些患者在接受芳香化酶抑制剂治疗期间或之后疾病复发或进展。研究旨在评估Capivasertib+氟维司群对比安慰剂+氟维司群的疗效和安全性。
主要终点方面,在全体人群中,capivasertib+氟维司群组和安慰剂+氟维司群组的中位PFS分别为7.2个月和3.6个月,capivasertib+氟维司群将疾病进展或死亡风险降低了40%(HR=0.60(0.51-0.71,two-sided P<0.001)。
据药融云数据库,Capivasertib在国内有至少5项III期临床试验在进行中,适应症包括激素受体阳性和人表皮生长因子受体2阴性的晚期乳腺癌、联合多西他赛用于治疗既往经过新型内分泌药物治疗后出现疾病进展的转移性去势抵抗性前列腺癌、新发PTEN缺失的转移性激素敏感性前列腺癌、三阴性乳腺癌等。
Capivasertib部分适应症研发进度(截至2023.10.09)

截图来源:药融云全球药物研发数据库
目前全球尚无ATK靶向药物上市。除了阿斯利康的Capivasertib外,全球范围内还有罗氏的ipatasertib(GDC-0068)和来凯医药从诺华公司引进的afuresertib(LAE002)等已进入关键临床研究阶段(含临床III期及注册临床II期)。此外,国内还有正大天晴的NTQ1062、海昶生物的WGI-0301、珍宝岛药业的HZB0071和浙江大学的Hu7691等药物研发进度靠前。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论