
据《药融云医药行业观察周报》统计,2023.08.28-2023.09.03 期间,迪哲医药、百济神州、正大天晴...等著名药企的创新药研发取得新进展,将为癌症、肿瘤、血友病...患者带来新希望。了解最新医药动态,监测仿制药/生物类似物注册申报详情,洞察最新医药行业发展方向,尽在《药融云医药行业观察周报》。
迪哲医药 JAK1 抑制剂「戈利昔替尼」拟纳入优先审评
近期,中国国家药监局药品审评中心(CDE)官网公示,迪哲医药的戈利昔替尼胶囊拟纳入优先审评,拟定适应症为:既往至少接受过一次标准治疗的复发或难治的外周 T 细胞淋巴瘤(r/r PTCL)成人患者。这也是戈利昔替尼首个开发的适应症。
外周 T 细胞淋巴瘤(PTCL)为恶性非霍奇金淋巴瘤,预后极差。目前 PTCL 的一线治疗方案仍以蒽环类药物为基础的 CHOP 或 CHOP 样化疗方案为主,但一线治疗后缓解的患者仍存在极高复发风险。一线治疗缓解后复发或治疗后未缓解的复发/难治性病例预后极差,患者缺少有效治疗手段。
戈利昔替尼是新一代口服、高选择性 JAK1 抑制剂,对治疗多种血液肿瘤、实体瘤和自身免疫性疾病都有潜在疗效。迪哲医药通过转化科学研究注意到,JAK/STAT 通路可能介导 PTCL 的发生发展,是治疗 PTCL 的高潜力靶点,并通过体外和体内多种研究模型验证了戈利昔替尼抗肿瘤活性。
戈利昔替尼基本信息
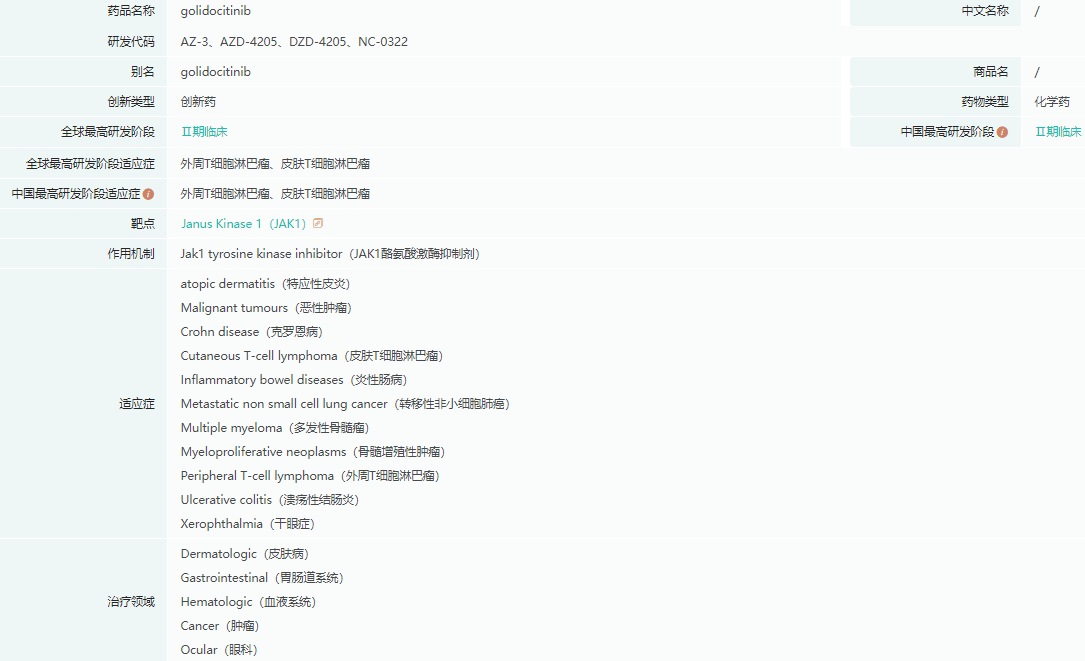
截图来源:药融云全球药物研发数据库
百济神州抗 PD-1 单抗新适应症上市申请获受理
近期,据CDE官网最新公示,百济神州递交了抗 PD-1 单抗替雷利珠单抗注射液的新适应症上市申请,并获得受理。
替雷利珠单抗(商品名:百泽安)是一款人源化 IgG4 抗药融云医药行业观察周报 16 程序性死亡受体-1(PD-1)单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的 Fcγ 受体结合,帮助人体免疫细胞检测和对抗肿瘤。
临床前数据表明,巨噬细胞中的 Fcγ 受体结合之后会激活抗体依赖细胞介导杀伤 T 细胞,从而降低了抗 PD-1 抗体的抗肿瘤活性。目前,替雷利珠单抗全球临床开发项目已在超过 30 个国家和地区开展超过 20 项注册相关的试验,入组超过 1.2 万例患者。
在中国,替雷利珠单抗已获批 11 项适应症,涵盖非小细胞肺癌(NSCLC)、经典型霍奇金淋巴瘤、尿路上皮癌、肝细胞癌、食管鳞状细胞癌(ESCC)、鼻咽癌、胃或胃食管结合部(G/GEJ)腺癌等等。其中,包括于今年在中国获批的两项新适应症,分别为联合化疗用于:一线治疗不可切除的局部晚期、复发或转移性 ESCC,以及一线治疗 PD-L1 高表达的晚期或转移性胃或胃食管结合部腺癌患者。此外,该产品用于一线不可切除或转移性肝细胞癌(HCC)的上市申请目前也正在审评中。
替雷利珠单抗适应症查询
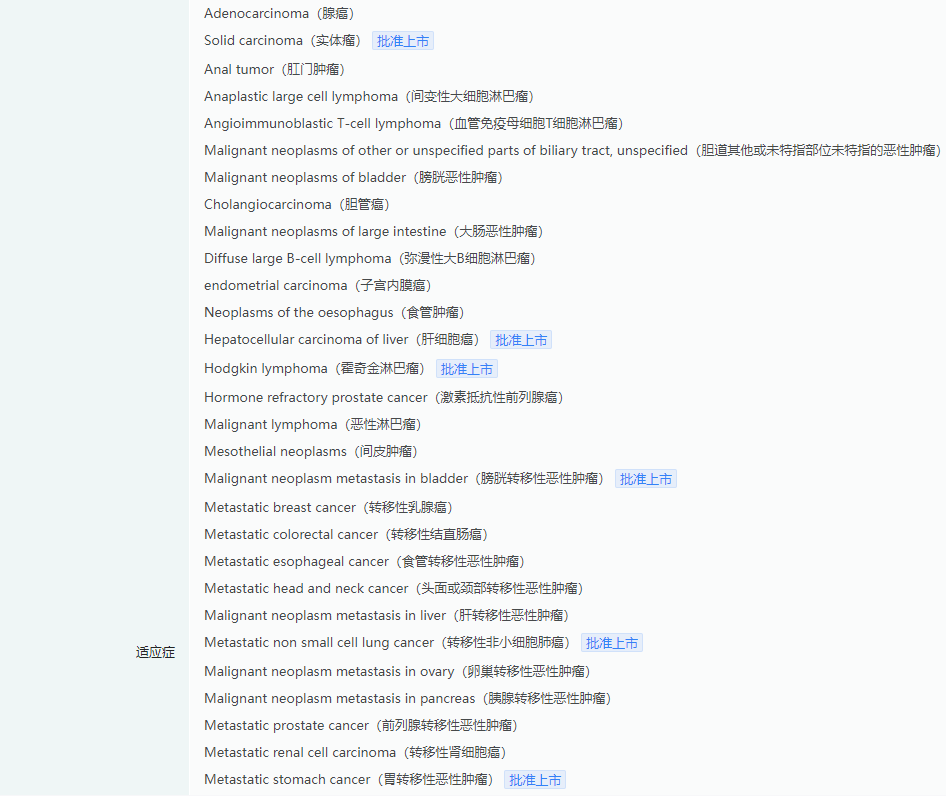

截图来源:药融云全球药物研发数据库
正大天晴「重组人凝血因子Ⅷ」在中国获批
近期,正大天晴宣布,已经收到中国国家药品监督管理局(NMPA)核准签发的《药品注册证书》,注射用重组人凝血因子Ⅷ(商品名:安恒吉)被批准用于 12 岁及以上血友病 A 患者(先天性凝血因子Ⅷ 缺乏)出血的预防。
安恒吉III期实验信息
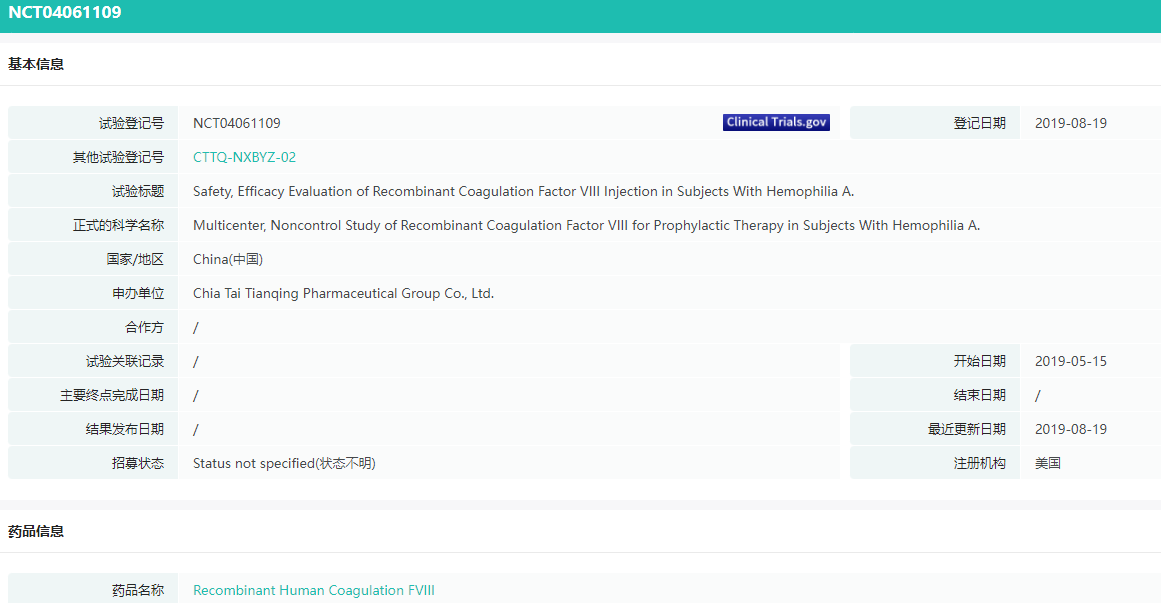
截图来源:药融云临床实验结果数据库
血友病 A 是一种由凝血因子Ⅷ(FⅧ)缺乏而导致的出血性疾病,是 X 染色体连锁的隐性遗传性疾病,主要由凝血因子Ⅷ基因突变引起。由于凝血因子Ⅷ缺乏,血友病 A 患者无法形成血小板凝集网络,终身面临极高的出血风险。
目前,血友病 A 的主要治疗手段是凝血因子Ⅷ替代治疗,包括人凝血因子和重组人凝血因子。《罕见病诊疗指南 2019》指出,血友病 A 的替代治疗首选人基因重组凝血因子Ⅷ制剂或病毒灭活的血源性凝血因子Ⅷ制剂。一旦出血,应尽早、有效地处理血友病患者的出血,避免并发症的发生和发展。根据正大天晴新闻稿介绍,其注射用重组人凝血因子Ⅷ的获批主要基于一项多中心、开放、非对照预防治疗的关键性临床试验。
研究结果显示,81 例既往接受过人凝血因子Ⅷ治疗的重度血友病 A 患者(≥12 岁)接受本品预防治疗治疗期间,48 例患者未发生出血事件,33 例患者发生 72 次新发出血事件,其中 56 次的出血事件可通过 1 次或 2 次输注止血。在可评价的 69 次新发出血事件中,13 次疗效评价为极好,45 次疗效评价为良好。
阿斯利康 BTK 抑制剂「阿可替尼」新适应症在中国获批
近期,中国国家药品监督管理局(NMPA)正式批准阿斯利康(AstraZeneca)血液肿瘤产品康可期(英文商品名:Calquence,通用名:阿可替尼胶囊)又一新适应症上市,单药适用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
阿可替尼胶囊中国药品审评
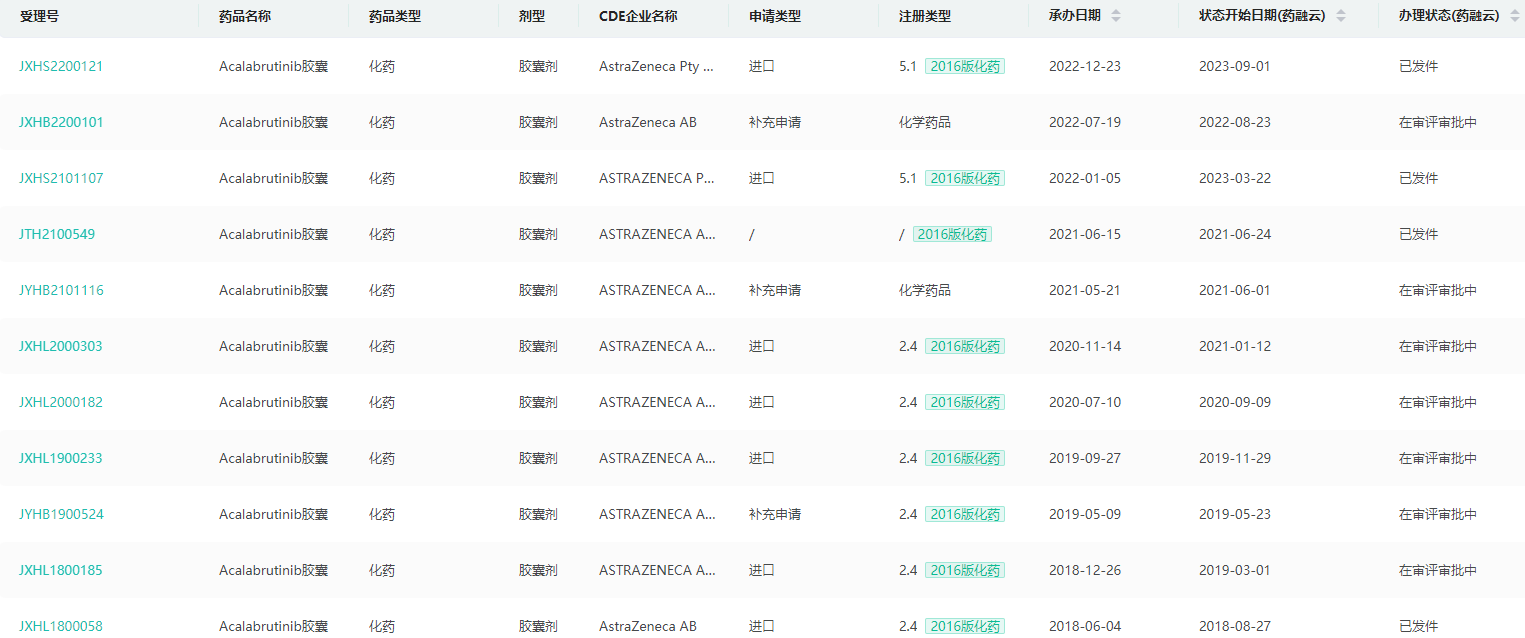
截图来源:药融云中国药品审评数据库
此前,该药已于今年 3 月在中国获批,用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。CLL/SLL 是成人白血病中的常见类型之一,此类疾病属于具有特定免疫表型特征的成熟 B 淋巴细胞克隆增殖性肿瘤,以淋巴细胞在外周血、骨髓、脾脏和淋巴结聚集为特征。由于 CLL 临床表现不明显、误诊率较高等原因,大多数患者就诊时已经发展至疾病相对晚期,严重威胁病人的生命健康。
阿可替尼是新一代选择性 BTK 抑制剂,它可以与 BTK 共价结合,抑制其活性。临床前实验表明,该产品具有对 BTK 较高的亲和力和特异性。在海外,阿可替尼于 2017 年获得美国 FDA 的加速批准,用于二线治疗套细胞淋巴瘤(MCL);于 2019 年再次获得 FDA 批准,作为初始疗法或后续疗法治疗慢性淋巴细胞白血病(CLL)或小细胞淋巴瘤(SLL)成人患者。
<END>
想要获取《药融云医药行业观察周报》完整报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往药融云“药融文库”网站【原创报告】栏目进行全文下载。































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论