
近日,河北森朗生物科技有限公司(以下简称森朗生物)收到美国食品药品监督管理局(FDA)孤儿药开发办公室(OOPD)正式书面回函,其自主研发的靶向CD7的CAR-T细胞产品(SENL101自体T细胞注射液)被授予孤儿药资格认定(ODD),用于治疗成人复发或难治性T淋巴母细胞淋巴瘤/白血病(T-LBL/ALL)。
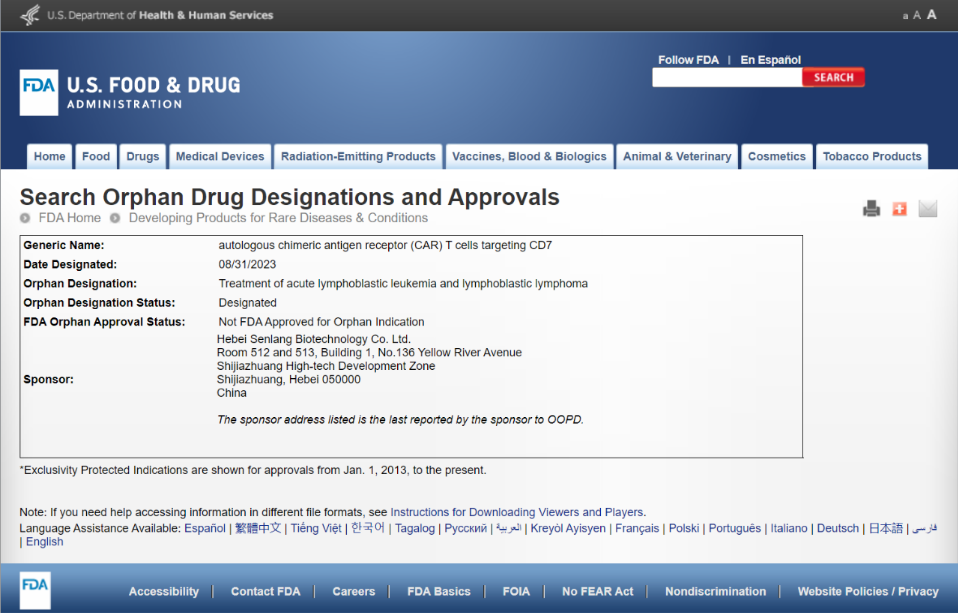
本次孤儿药资格认定主要基于SENL101自体T细胞注射液完善的临床前研究和在国内开展研究者发起的临床研究中的积极结果。在获得孤儿药资格后,SENL101自体T细胞注射液将有资格享受若干优惠政策,包括FDA对临床研究指导支持、特殊费用减免、在美国享受上市申请快速通道,以及批准上市后产品在美国的七年市场独占权等。
SENL101自体T细胞注射液是由森朗生物自主开发的具有完全自主知识产权的基于CD7纳米抗体的CAR-T细胞产品,其治疗T-LBL/ALL的疗效和安全性已在早期临床研究中得到验证,于2023年6月19日获得国家药品监督管理局(NMPA)的IND批件,并连续在BLOOD杂志和美国血液学会年会上进行展示,获得国际同行的高度认可。
SENL101全球研发进度
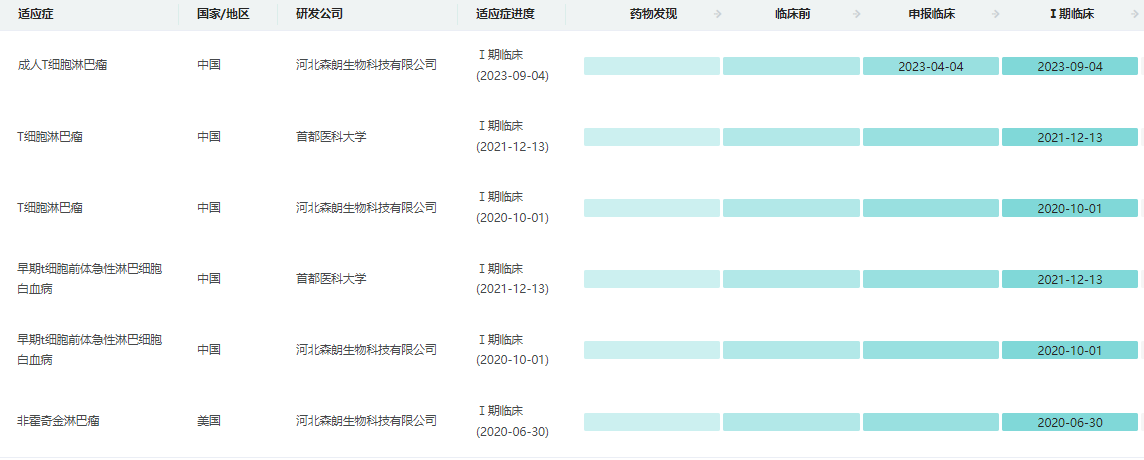
数据来源:药融云全球药物研发数据库
目前,森朗生物已建成高效的细胞治疗创新技术平台,并在此平台上研发生产了包括新型靶向CD19 CAR-T、靶向CD7 CAR-T、组合(Combo)CAR-T、通用型 CAR-γδT 以及针对实体瘤的多个领先产品,用于治疗急性淋巴细胞白血病、淋巴瘤等主要血液肿瘤和肝癌等实体肿瘤。
研发管线

森朗生物建有5000平米CAR-T研究中心,拥有自主技术的纳米抗体CAR-T开发平台,具备病毒、质粒、细胞培养、检测、临床试验等全流程覆盖的自主产品研发体系。目前公司正在开展新车间设计工作,后续将实现产品的规模化生产。
参考资料:
1.森朗生物
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论