
密切关注国内创新药/改良型新药研发的最新进展,《药融云医药行业观察周报》及时为您传递最前沿的医药信息,让您紧跟医药科技的发展步伐,把握生命健康的未来趋势。
一、国内创新药/改良型新药注册申报分析
据《药融云医药行业观察周报》数据统计,2023.08.21-2023.08.27期间,国内共有57个创新药/改良型新药注册申请获CDE承办(按受理号统计,不含补充申请)。其中,国产药品受理号42个,进口药品受理号15个。
在这期间,共计46款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药23款,生物药23款。其中值得关注的有齐鲁制药的QLH12016胶囊、康缘药业的KYS202002A注射液、人福医药的HW060015胶囊、百济神州的BGB-15025片与苹果酸司曲替尼胶囊、恒瑞医药的HRS-6209片等等。
QLH12016胶囊——用于治疗前列腺癌
齐鲁制药1类新药QLH12016胶囊获批临床,可用于治疗包含晚期前列腺癌在内的恶性实体瘤。QLH12016胶囊是一款PROTAC(靶向蛋白降解嵌合体)产品,PROTAC技术药物的结构中包括靶蛋白配体、连接子和E3连接酶配体,其中靶蛋白配体可特异性地与靶蛋白结合,另一端通过募集E3连接酶形成三元复合物,E3连接酶可介导E3泛素结合酶对靶蛋白泛素化,被泛素标记的靶蛋白被蛋白酶体识别并降解。
近年来,PROTACs的研发非常火热,国内外企业纷纷布局,比如国外制药巨头罗氏、辉瑞、拜耳、默沙东、GSK、诺华、阿斯利康等;以及Arvinas,C4Therapeutics,海思科、恒瑞医药、百济神州、开拓药业等企业争相加码PROTAC领域。
全球布局PROTAC领域企业及管线查询
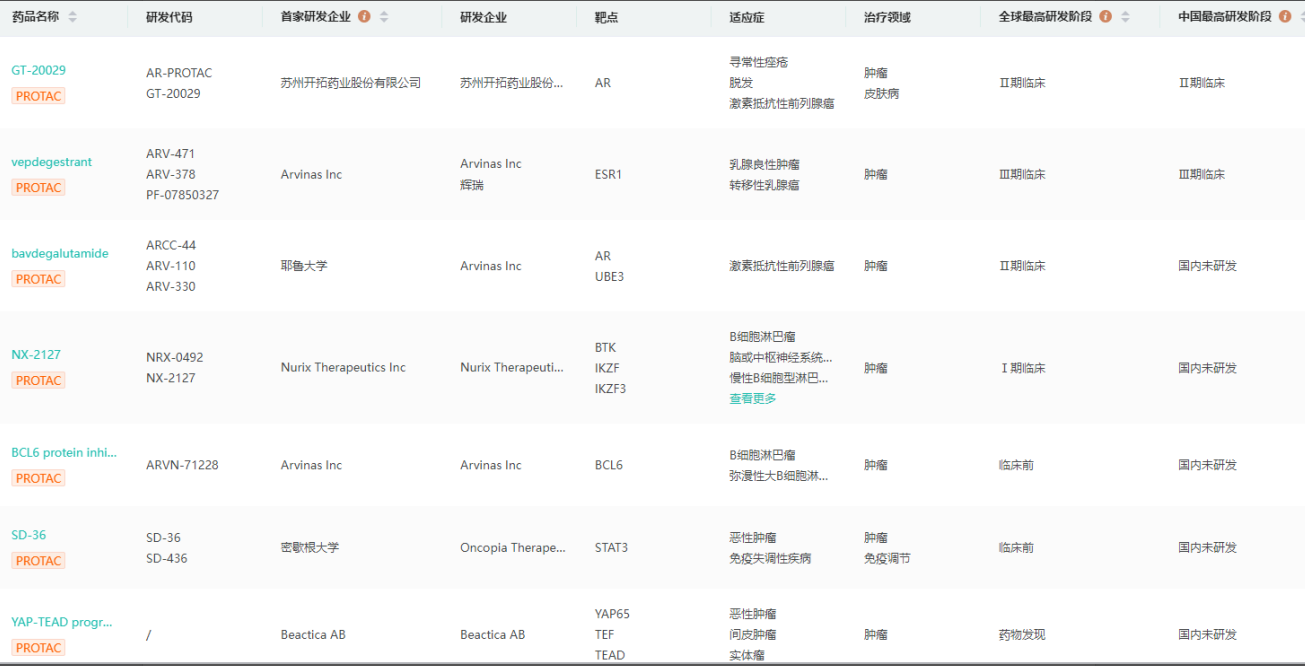
图片来源:药融云全球药物研发数据库
药融云全球药物研发数据库显示,目前在蛋白降解药物研发赛道上,国内企业进展较快的有开拓药业的GT20029(II期临床),海思科的HSK38008、HSK-29116(I期临床),凌科药业的LNK-01002(I期临床),冰洲石生物的AC-0176(I期临床),海创药业的HP518(申报临床)等。GT20029是全球首个进入II期临床试验的外用PROTAC化合物,适应症为雄秃。
TAVO412注射液——全球首个靶向EGFR、cMET和VEGF的多特异性抗体
拓创生物的TAVO412注射液获得临床试验默示许可,拟用于标准治疗期间或之后出现疾病进展的局部晚期或转移性实体瘤(尤其是胃癌、肝癌和其他消化系统癌症)。
TAVO412是一款全球首个靶向EGFR、cMET和VEGF的多特异性抗体,可以在协同关闭EGFR和cMET信号通路的同时,阻断肿瘤内的血管生成。TAVO412在众多实体瘤领域包括肺癌、胰腺癌、三阴乳腺癌、胃癌等表现出良好的疗效及安全性,未见明显的靶点相关不良反应。
药融云医药投融资数据库显示,拓创生物仅2021年就完成了三轮融资,投资机构包括国投招商、丰川资本、清松资本等。目前拥有7款正在开展临床研究的产品,如两款雄激素受体(AR)拮抗剂、AR-PROTAC化合物、ALK-1单抗、Hedgehog抑制剂、mTOR激酶靶向抑制剂和PD-L1/TGFβ双靶点抗体,以及正在进行临床前研究的ALK-1/VEGF双抗和c-Myc抑制剂等。
拓创生物研发管线查询

图片来源:药融云全球药物研发数据库
二、新药获批上市情况
在2023.08.21-2023.08.27期间,共有2款创新药/改良型新药获批上市,分别是舒沃替尼片和Inclisiran注射液。
舒沃替尼片——靶向治疗非小细胞肺癌
迪哲医药研发的1类创新药舒沃替尼片(商品名:舒沃哲)获批上市,用于治疗既往经含铂化疗治疗时或治疗后出现疾病进展,或不耐受含铂化疗,并且经检测确认存在表皮生长因子受体(EGFR)20号外显子插入突变的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
舒沃替尼(Sunvozertinib,DZD9008)是一款口服、不可逆、针对多种EGFR 突变亚型的高选择性 EGFR 酪氨酸激酶抑制剂(TKI)。药融云数据库显示,舒沃替尼片于2020年12月在中国获得突破性疗法认定。后于2022年1月,被美国FDA授予突破性疗法认定。
舒沃替尼片此次获批主要基于舒沃替尼中国注册临床试验(悟空6,WU-KONG6)的卓越数据,该研究是一项针对含铂化疗进展或不耐受的 EGFR exon20ins 晚期 NSCLC 患者的单臂、多中心 2 期注册研究,结果显示舒沃替尼在以300 mg一次给药时实现了60.8%的总客观缓解率(ORR),疾病控制率(DCR)高达 87.6%。
舒沃替尼片全球研发进度查询
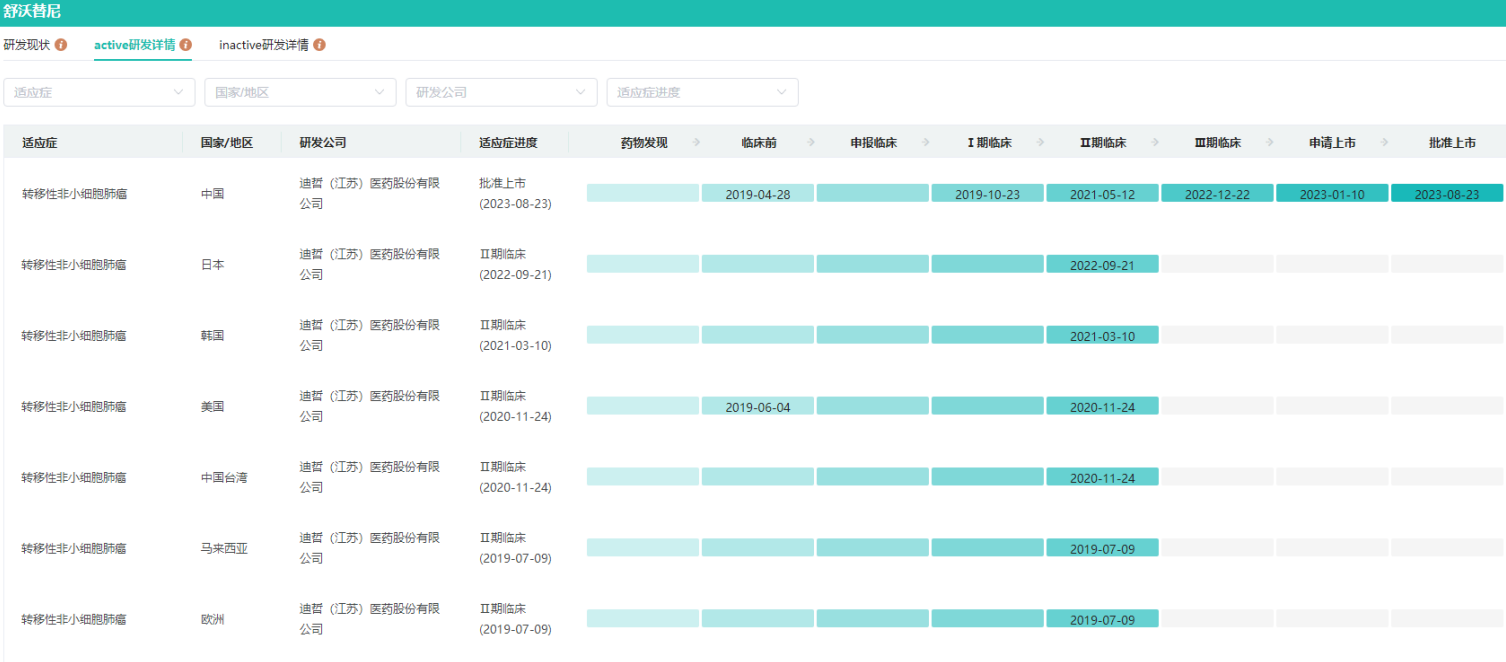
图片来源:药融云全球药物研发数据库
Inclisiran注射液——中国境内首款siRNA药物!
Inclisiran注射液(商品名:Leqvio,乐可为)是由诺华研发的一种小干扰RNA降胆固醇药物,作为饮食的辅助疗法,用于成人原发性高胆固醇血症(杂合子型家族性和非家族性)或混合性血脂异常患者的治疗。同时也是中国境内批准上市的第一个siRNA药物。
Inclisiran是一款靶向PCSK9的小干扰核酸(siRNA)疗法,可直接与编码PCSK9蛋白的mRNA结合,通过RNA干扰作用降低mRNA的水平,从而防止肝脏生成PCSK9蛋白,每年进行两次Inclisiran注射即可降低低密度脂蛋白胆固醇(LDL-C),是一款长效降脂siRNA 疗法。
Inclisiran作为全球首款也是目前唯一一款靶向前蛋白转化酶枯草溶菌素PCSK9,用于降低“坏胆固醇”低密度脂蛋白胆固醇LDL-C的siRNA药物,开启了血脂管理的新时代。
Inclisiran注射液审评时间轴-获批进口耗时279天
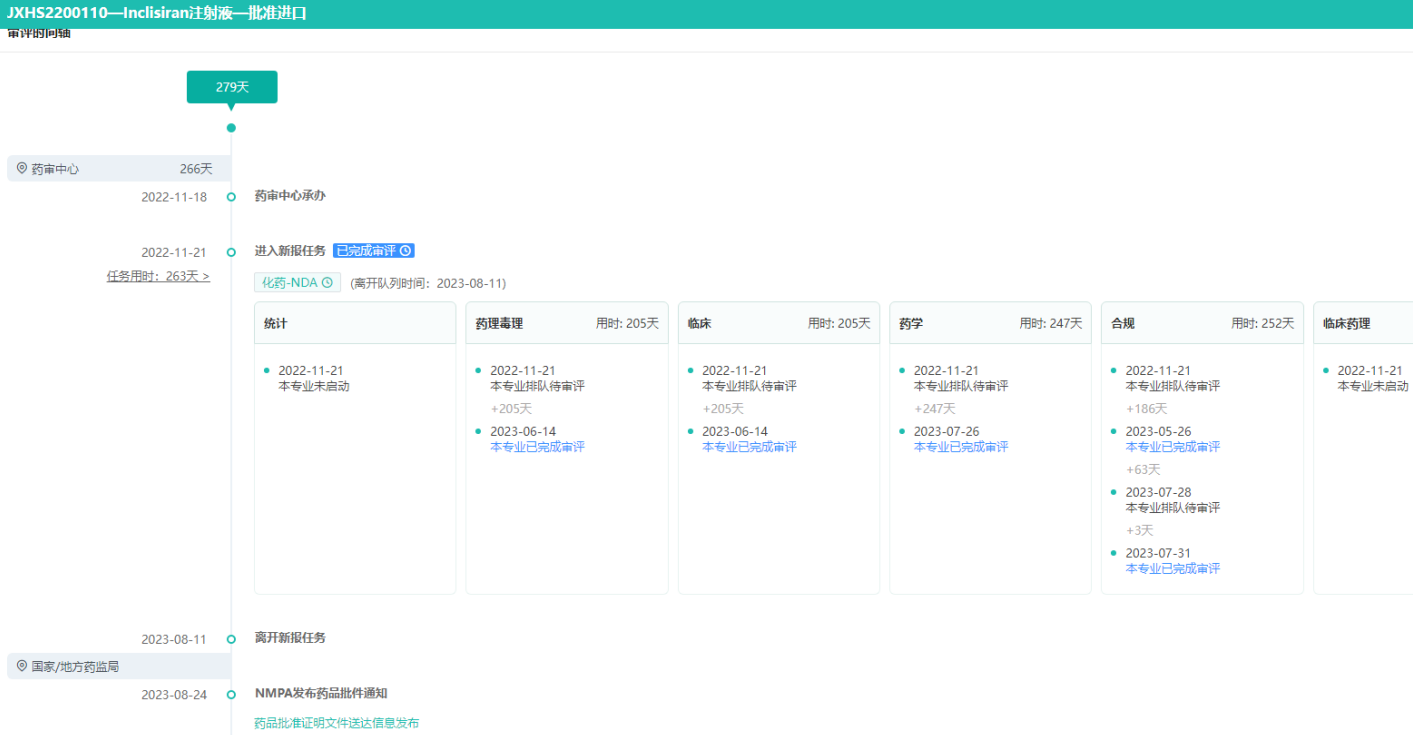
图片来源:药融云中国药品审评数据库
药融云数据库显示,目前国内PCSK9靶向疗法风头正盛。除了诺华的Inclisiran,信达生物的抗PCSK9单抗IBI-306也于2023年8月获NMPA批准上市。除此之外,康方生物的AK-102、恒瑞医药的SHR-1209、君实生物的JS-002也递交了新药上市申请,信立泰的SAL-003处于III期临床研究阶段。
<END>
想要获取《药融云医药行业观察周报》完整报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往药融云“药融文库”网站【原创报告】栏目进行全文下载。












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论