
近日,国内首个获批IND批件的TCR-T细胞免疫治疗产品TAEST16001的I期临床研究成果在国际期刊Cell Reports Medicine(IF=16.988)上正式发布。

TCR-T细胞免疫治疗是指从患者获取外周血单个核细胞(PBMC)样本,通过基因工程改造的方法,将筛选到的高亲和力T细胞受体(T-cell receptor,TCR)导入T细胞,使其能够识别和攻击肿瘤细胞。高亲和力的TCR-T细胞回输至患者体内后,可以寻找并特异识别肿瘤细胞,通过激活机制释放细胞因子、穿孔素等对肿瘤细胞进行连续杀伤,从而发挥清除肿瘤的效应。
TAEST16001基本信息
数据来源:药融云全球药物研发数据库
据了解,TAEST16001是香雪生命科学技术(广东)有限公司(以下简称香雪生命科学)自主研发的TCR-T细胞免疫治疗产品,该产品首个I期临床试验为TAEST16001细胞在HLA-A*02:01阳性并且表达NY-ESO-1抗原的晚期软组织肉瘤患者中进行的剂量递增和拓展性研究。根据香雪生命科学官方信息,从2020年3月23日至2021年12月31日,共有12名晚期软组织肉瘤患者入组(10例为滑膜肉瘤,2例为脂肪肉瘤),其中,83.3%的患者既往至少接受过2线化疗。
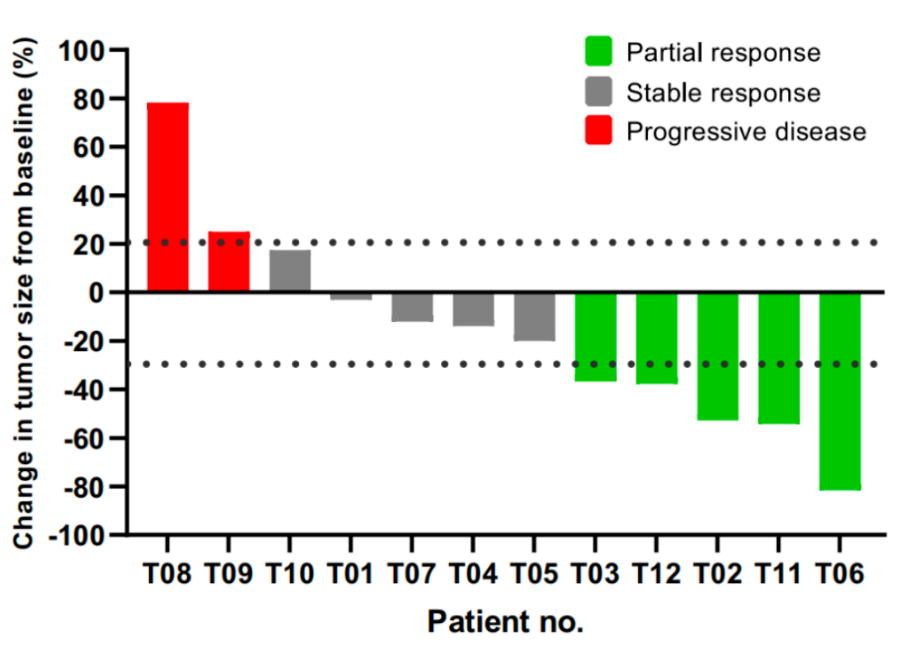
瀑布图-单个可评估患者的最佳临床反应 图片来源:香雪生命科学官网
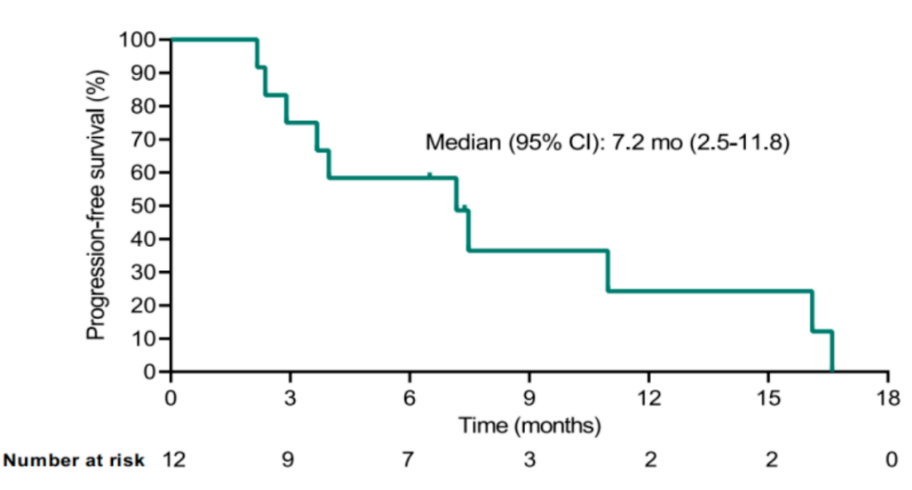
Kaplan-Meier-预估的无进展生存期(PFS),删失数据的时间为受试者的最后联系日期 图片来源:香雪生命科学官网
在初步分析时,12例患者中有5例的最佳缓解是部分缓解,ORR为41.7%[95%Cl,15.2-72.3];5例(41.7%[95%Cl,15.2-72.3])患者病情稳定,疾病控制率为83.3%[95%Cl,51.6-97.9],中位无进展生存期(PFS)为7.2个月[95%CI,2.5-11.8]。截至数据截止时(2022年4月15日),10例患者出现疾病进展,其中1例因疾病死亡,中位OS尚不成熟。
安全性方面,TAEST16001细胞治疗耐受性良好,未观察到剂量限制性毒性(DLTs)。有两名患者出现细胞因子释放综合征,均为2级,并在给予对症治疗后消退,所有患者均未出现神经毒性或与细胞输注相关的严重不良事件。目前,TAEST16001正在进行二期临床研究。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)














 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论