2023年5月8日——百力司康生物医药(杭州)有限公司("百力司康")宣布,与卫材株式会社("卫材")就BB-1701达成具有战略合作选择权的临床试验合作协议。BB-1701是一款以艾立布林为毒素的治疗癌症的HER2 ADC药物。
根据协议,百力司康将获得首付款和里程碑付款,百力司康和卫材将就BB-1701进行共同开发。如卫材行使BB-1701战略合作的选择权,百力司康会获得相应的行权付款,同时将获得总计高达20亿美元的开发与商业化里程碑付款, 以及销售分成,卫材会获得该HER2 ADC药物的全球(除大中华区外)开发和商业化权益。
本次与卫材的合作标志着百力司康企业发展规划中就BB-1701全球开发向前迈进了重要的一步,有助于该HER2 ADC药物的后期开发推进。BB-1701目前正在进行中美I/II期临床试验,已有上百例不同癌种患者用药。

魏紫萍博士
百力司康首席执行官魏紫萍博士表示,卫材是日本领先的医药公司之一,有着强大的全球肿瘤药研发能力。本次与卫材达成的临床合作对百力司康有着重大的意义,有助于进一步开发具有广泛市场前景的肿瘤药BB-1701。通过此次重要的合作,我们会同卫材共同推进BB-1701的开发,使全球患者获益。
一、关于BB-1701
BB-1701是一款由百力司康开发的由抗HER2(人表皮生长因子受体-2)抗体和艾立布林结合的创新ADC药物,旨在为局部晚期和转移性HER2阳性实体瘤患者提供更加安全有效的治疗方案, 具有应用于多种肿瘤适应症的市场前景。该HER2 ADC药物具有独特的作用机制(MOA),包括有效的旁路杀伤效应以及免疫原性细胞死亡(ICD)活性。
BB-1701药物研发信息(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
据药融云数据库显示,BB-1701目前正在进行中美I/II期国际多中心临床试验,其中,针对尿路上皮转移性恶性肿瘤的临床试验在中国已推进到临床2期。另外。2023年2月22日,百力司康向中国药审中心递交了一项注射用BB-1701的新药补充申请,现在审评审批中。
BB-1701中国审评情况
截图来源:药融云中国药品审评数据库
二、关于百力司康
百力司康是一家的专注于抗肿瘤生物创新药的研发和产业化的临床阶段的生物医药企业。百力司康拥有独特的自主知识产权技术平台、丰富的ADC产品管线,以及能够支持抗体和ADC生产并应用于临床开发和早期商业化的GMP自有产能。
百力司康在研管线
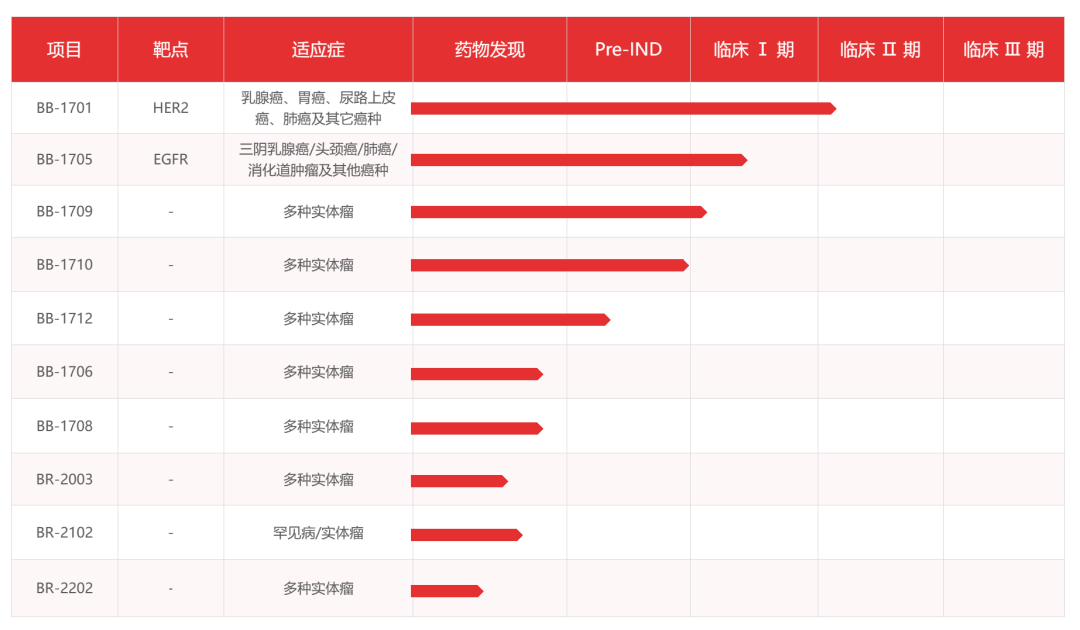
来源:百力司康官网
参考资料:
[1] 百力司康官网
[2] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论