4月27日,据CDE官网显示,恒瑞医药自主研发的IL-17A单抗——夫那奇珠单抗注射液(Vunakizumab,SHR-1314)的上市申请获得国家药监局受理。拟定适应症为治疗适合接受系统治疗或光疗的中重度斑块状银屑病的成人患者。截至目前,国内还尚无国产IL-17A单抗上市,恒瑞医药有望创造历史,打破国内空白。

截图来源:CDE官网
据悉,SHR-1314是恒瑞医药自主研发的一款靶向人IL-17A的重组人源化单克隆抗体(IL-17A单抗),拟用于治疗与IL-17通路相关的自身免疫疾病。与IL-17A结合后抑制下游细胞因子,阻断炎症信号传导。目前,SHR-1314在国内的临床试验已达到主要终点,此次申报上市。另外,SHR-1314在澳大利亚和美国针对银屑病的临床试验也已经开展到了2期阶段。
SHR-1314在中国开展的临床试验
截图来源:药融云中国临床试验数据库
2023年2月,SHR-1314注射液Ⅲ期临床试验(SHR-1314-301)主要研究终点达到方案预设的优效标准。该研究是一项评价SHR-1314注射液治疗成人中重度慢性斑块状银屑病的疗效和安全性以及药代动力学的多中心、随机、双盲、平行、安慰剂对照的临床Ⅲ期研究。
研究共入组690例成人中重度慢性斑块状银屑病受试者,按照2:1随机入组,分别接受SHR-1314注射液240mg或安慰剂治疗。研究结果表明,第12周时,达到了主要研究终点及关键次要研究终点,与安慰剂相比,SHR-1314对中重度斑块状银屑病具有统计学显著性和临床意义的改善。
据药融云数据库查询,目前国内已有3款IL-17A单抗获批上市。分别为诺华的司库奇尤单抗、礼来的依奇珠单抗以及协和麒麟的布罗利尤单抗。其中,司库奇尤单抗和依奇珠单抗分别于2019年4月和9月作为第一批临床急需境外新药在中国获批上市。据药融云统计,2022年两者在院内的市场规模合计达到了约15亿人民币。
目前在中国市场上,诺华的司库奇尤单抗注射液(商品名:可善挺)共有4种规格流通销售。其实在上市的前两年,司库奇尤单抗的销售额并不理想,直到医保谈判成功,被纳入了国家医保乙类目录后(2021年3月1日开始执行),该IL-17A单抗立马出现“响应”,院内市场快速放量,2021年的销售额大涨1381.15%,一举冲到5.7亿。近日,药融云全国医院销售数据库更新了2022年的全国药品销售数据,司库奇尤单抗的销售依然势如破竹,全年售卖了14亿。
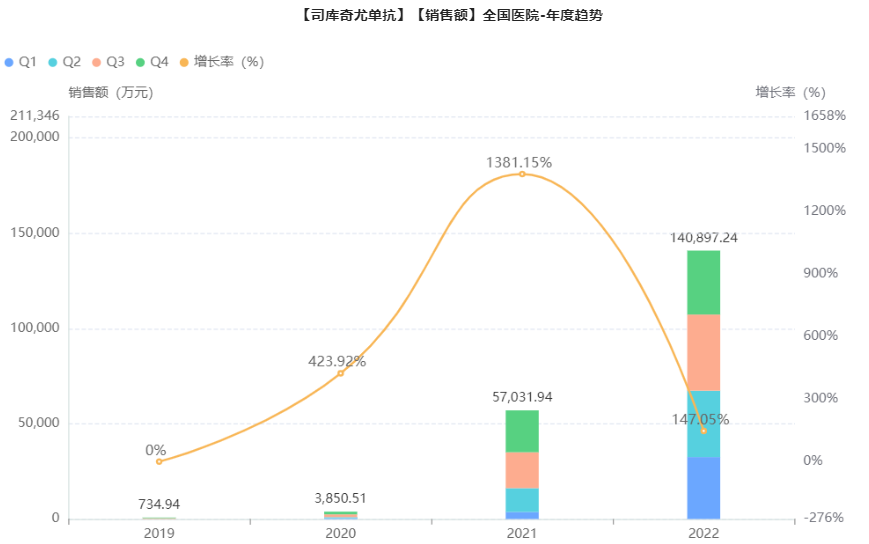
截图来源:药融云全国医院销售数据库
在国内IL-17A单抗研发中,智翔金泰的赛立奇单抗和恒瑞医药的夫那奇珠单抗已申报上市,两者均有望成为国内首款。三生国健的608和康方生物的AK111均已进入III期临床阶段。其他正在开发IL-17类生物制剂的国内药企还包括华奥泰生物、创响生物、君实生物等。
参考来源:
[1] CDE官网
[2] 药融云数据库
[3] 恒瑞医药官方披露
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论