2月21日,CRISPR Therapeutics(纳斯达克:CRSP)发布2023财报,公司的现金、现金等价物及有价证券为18.68亿美元,同比下降21.5%,研发费用投入4.62亿美元,同比增长35.5%,2022全年净亏损为6.50亿美元。
4月13日,CRISPR股价上涨了约15%,目前市值40亿美元。
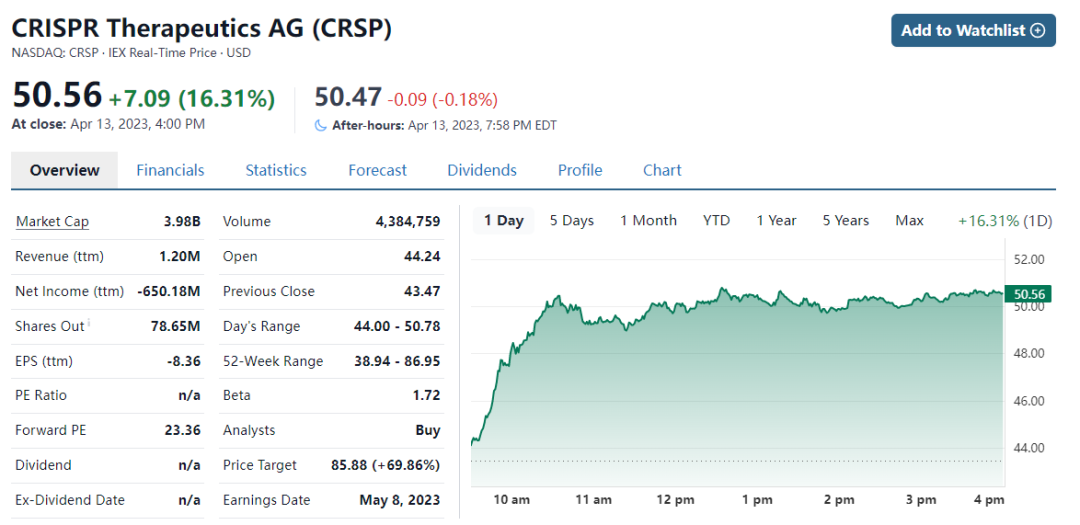
近日,美国金融服务公司Cantor Fitzgerald分析师Olivia Brayer表示,CRISPR公司的CRISPR基因编辑疗法exagamglogene autotemcel(exa-cel)有望在今年进行首次商业化,此次股价的上涨或许就与exa-cel即将上市与有关。分析师预计通过FDA优先审查的成功概率为90%,普遍预期上市后销售额为13亿美元,最高销售额或可达16亿美元(剔除风险因素)。
该CRISPR基因编辑疗法用于治疗镰状细胞病(SCD)和β地中海贫血(TDT)。据药融云数据库显示,exa-cel针对镰状细胞病和β地中海贫血的临床中,两项均显示出积极的试验结果,数据分别为free of VOCs:100%、transfusion-free:95%。
exa-cel临床试验结果
截图来源:药融云临床试验结果数据库
4月3日,CRISPR和Vertex宣布exa-cel完成了向FDA提交生物制剂许可申请(BLAs)。BLA包括优先审查的请求,如果获得批准,FDA对申请的审查时间将从提交之日起缩短至8个月,而标准审查时间为12个月。
如果exa-cel顺利获批,将成为首款获批上市的CRISPR基因编辑疗法。
对于excel-cel的定价预测,4月12日,药品价格监管机构临床和经济审查研究所(ICER)发布了一份报告草案,估计excel-cel的定价为190万美元,很可能与蓝鸟生物的两款基因疗法(治疗镰状细胞病的lovo-cel和治疗β地中海贫血的Zynteglo)进行竞争,目前Zynteglo的定价为280万美元。
exa-cel目前的进展:
在美国,FDA已授予exa-cel再生医学先进治疗(RAT)、快速通道、孤儿药和罕见儿科疾病称号,用于SCD和TDT。
在英国,exa-cel还根据英国药品和保健产品监管机构(MHRA)的创新许可和准入途径(ILAP)资格获得了创新护照。
在欧洲,exa-cel的上市许可申请(MAAs)于2022年12月提交,并于2023年1月由欧洲药品管理局(EMA)和药品和保健产品管理局(MHRA)进行验证。
在欧盟,exa-cel已经获得了来自欧盟委员会的孤儿药指定,以及来自EMA的优先药物(PRIME)指定,批准该CRISPR基因编辑疗法用于SCD和TDT。
exa-cel获得的特殊审批认证
截图来源:药融云全球药物研发数据库
关于Vertex和CRISPR的合作
2015年,CRISPR和Vertex达成战略合作,专注于利用CRISPR/Cas9发现和开发针对人类疾病潜在遗传原因的潜在新治疗方法。exa-cel是该联合研究项目中第一个潜在治疗方法,该CRISPR基因编辑疗法就快要取得胜利果实。根据协议,Vertex负责exa-cel的全球开发、制造和商业化,并与CRISPR在全球范围内以60/40的比例分割项目成本和利润
关于CRISPR
CRISPR Therapeutics主要研究CRISPR-Cas9基因编辑技术及其在β地中海贫血、血友病、杜氏肌营养不良症、囊性纤维化等疾病治疗中的应用。
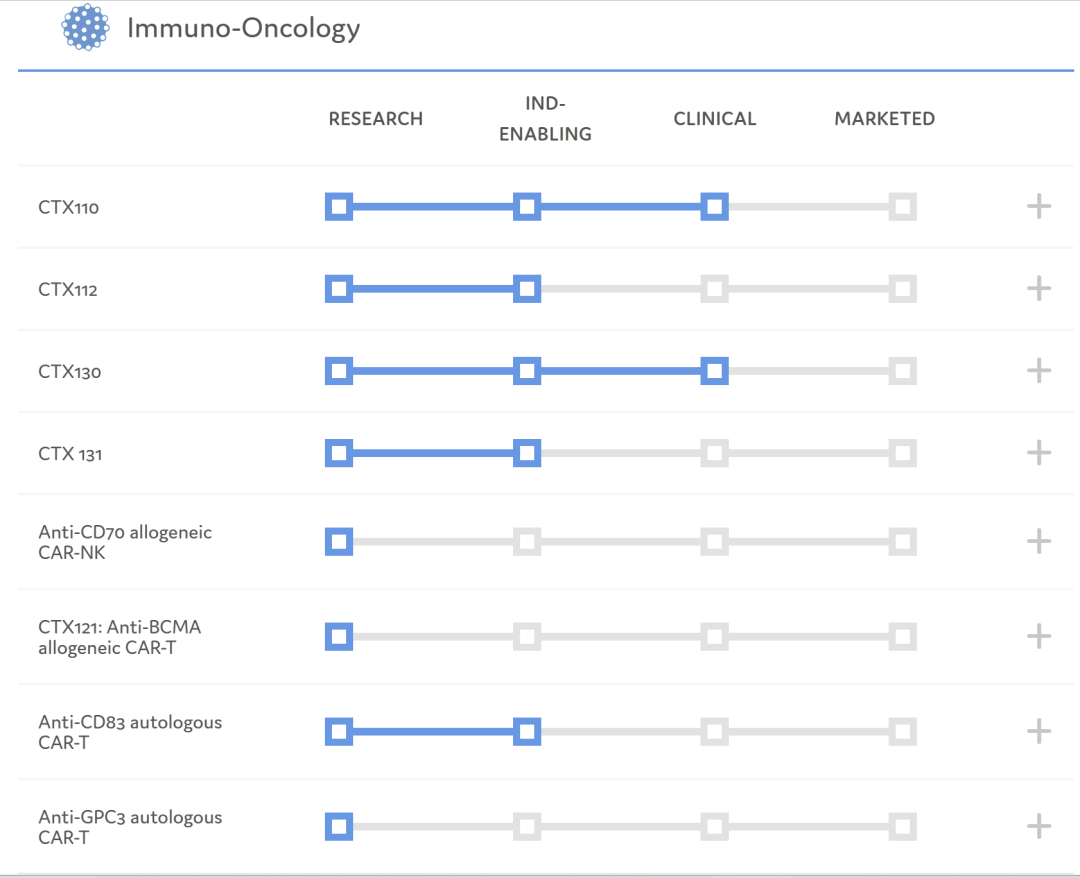
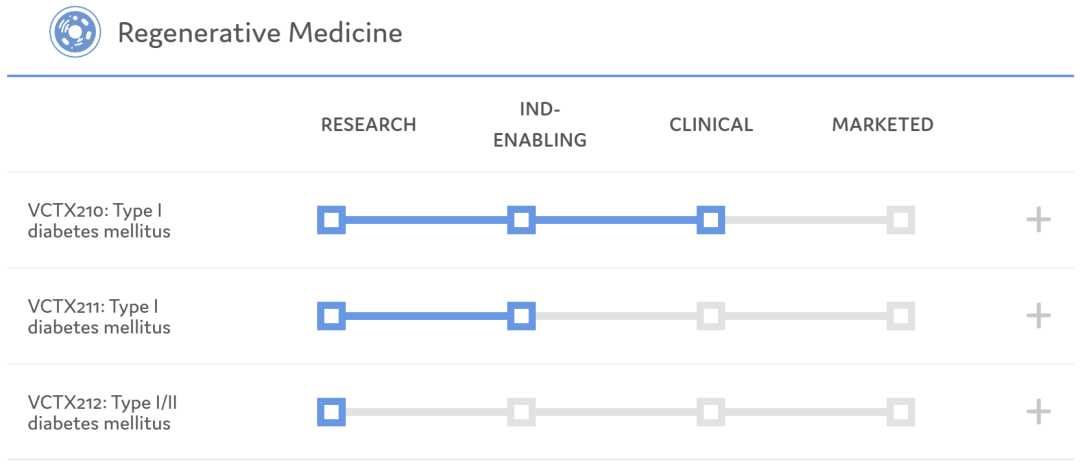
研发管线


结语
基因编辑疗法作为一种一次性治愈治疗方案,其有效性毋庸置疑,但是研发成本十分高昂,有限的受众群体又注定了药企需要设定高价来保证公司的前期投入有所回报,数百万的定价在基因治疗领域已经成为了一种常态。也许在技术水平提高、支付手段创新的未来,基因编辑疗法的普适性会增加。
参考资料:
[1] 药融云数据库
[2] www.crisprtx.com
[3] www.seekingalpha.com
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)















 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论