3月27日,石药集团发布公告,其阿普米司特片(10mg,20mg,30mg)获得药品注册批件,用于治疗符合接受光疗或系统治疗指征的中度至重度斑块状银屑病的成人患者。此前曾有多家企业以仿制新3类报产该$22亿银屑病高难度品种,但均折戟成沙,终未获批。石药集团为这一热门品种的“国内首仿药+首家过评”。

截图来源:石药集团官网
阿普斯特/阿普米司特(apremilast)原研由新基(Celgene)研发,是过去二十多年用于银屑病/银屑病关节炎治疗的首个口服新药。在全球市场,阿普米司特片于2014年3月首次面世,被美国FDA批准用于治疗成人活动性银屑病性关节炎、符合接受光疗或系统治疗指征的中度至重度斑块状银屑病的成人患者。截止目前,阿普米司特已在美国、欧盟、加拿大、挪威、日本、中国等50多个国家获批,进入市场销售。
阿普米司特研发现状(微信搜索"药融云小程序"进行相关更多数据查询)
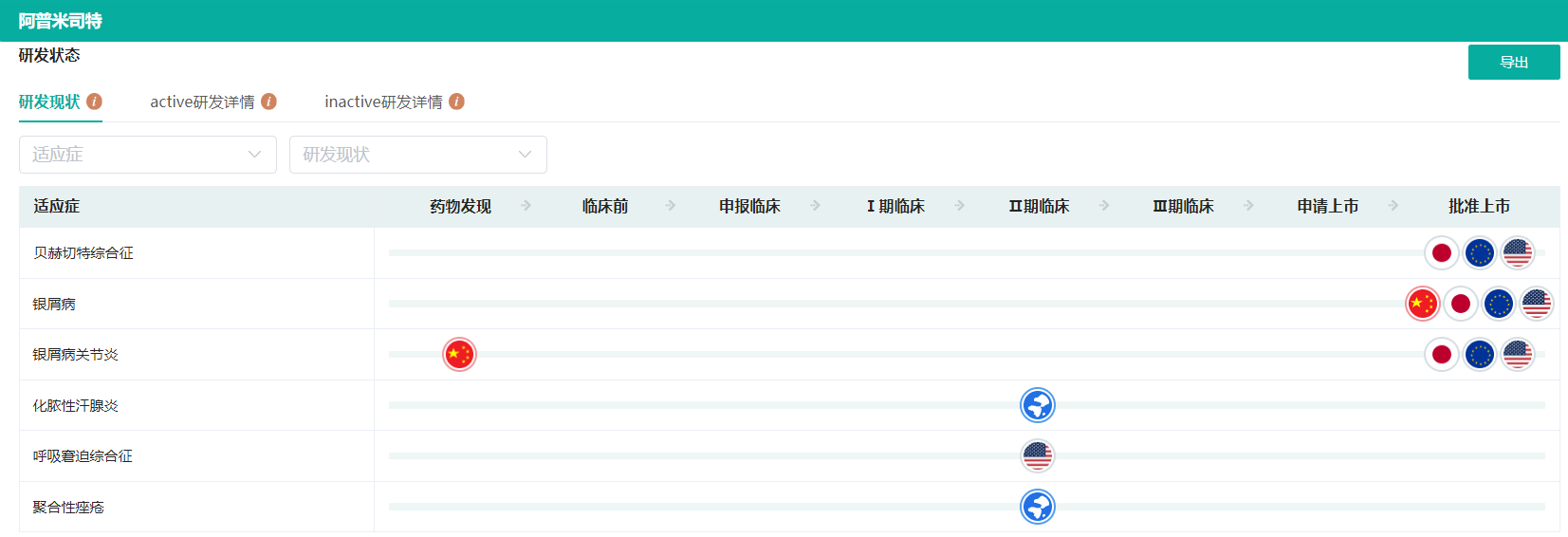
截图来源:药融云全球药物研发数据库
2019年8月,安进以高达134亿美元的价格获得了阿普米司特的全球权益。2021年8月,安进在中国提交的阿普米司特上市申请获批,用于治疗符合接受光疗或系统治疗指征的中度至重度斑块状银屑病的成人患者。这是中国首个获批用于斑块状银屑病治疗的口服PDE4抑制剂。据药融云全球药物研发数据库显示,阿普米司特在2020年度实现21.95亿美元的全球销售额;2021财年为22.49亿美元。
我国约有650万银屑病患者,中重度患者约占57.3%。故国内对于银屑病相关治疗药物的需求十分迫切。
2022年6月,复星医药与安进宣布,就两款创新药物——欧泰乐®(阿普米司特片)和Parsabiv®在中国境内(不包括港澳台地区)的商业化授权许可先后达成合作。2022年底,复星医药的阿普米司特片通过谈判进入医保目录(乙类)。不言而喻,该产品在我国的销售前景备受看好。因此,国内有多家企业进行积极布局,对于国内首仿药的位置更是虎视眈眈。
阿普米司特原研批文
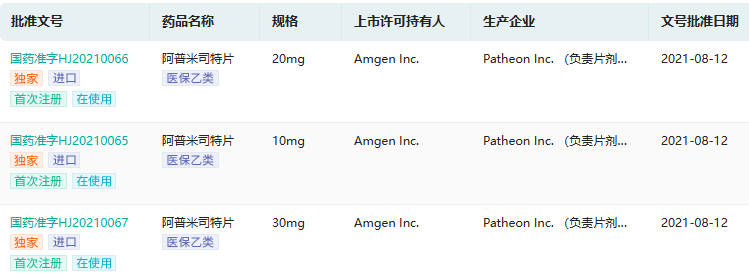
截图来源:药融云中国药品批文数据库
2021年8月(原研未在中国获批上市)以前,国内已有多家药企按化药3类递交了上市申请,但由于本品为高难度品种,故均未被批准上市。目前,国内也已有十余家药企先后递交4类仿制上市申请,其中不乏齐鲁制药、先声药业、兆科药业、华润双鹤、青峰药业等明星药企。此次石药集团欧意药业获批,顺利拿下阿普米司特片的国内首仿药,同时也是国内首家过评的药企。
阿普米司特片报产在审企业
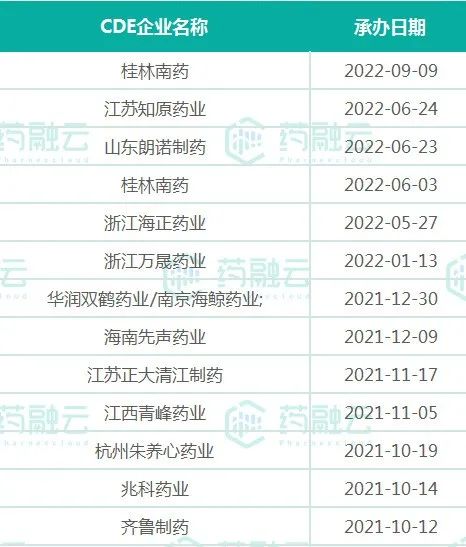
数据来源:药融云中国药品审评数据库
参考来源:
[1] 药融云数据库
[2] CDE官网/NMPA官网
[3] 石药集团公司官方披露
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论