
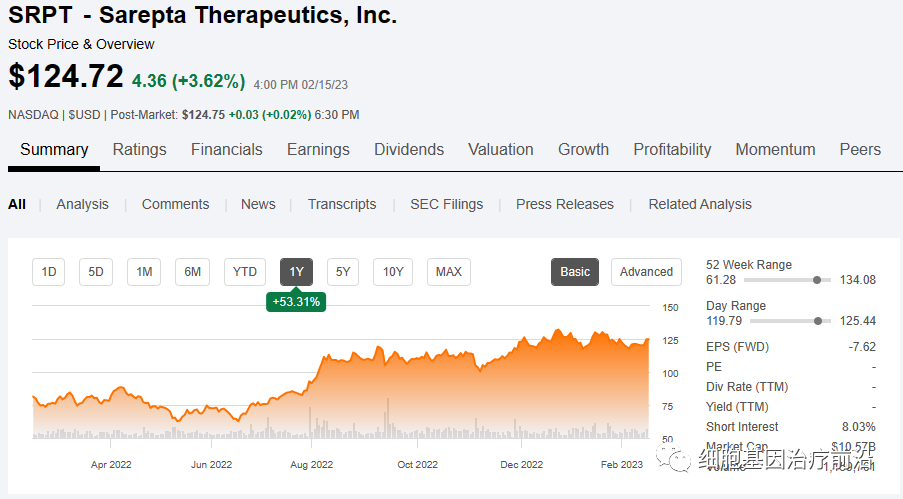
近期,小核酸药物龙头Sarepta Therapeutics发布2022年业绩预告:2022年全年的净产品收入为8.433亿美元(约为57亿人民币),同比增长38%,符合预期。公司表示净产品收入不包括合作收入。

其中Q4公司的净产品收入约为2.355亿美元,比2021年同期增长32%,公司在手现金及其等价物为20亿美元,业绩持续增长。Sarepta Therapeutics股价在过去一年涨幅超过50%,目前124美元/股,市值高达106亿美元(约726亿人民币)。(1美元≈ 6.8493人民币)
年报预告中暂未披露重点产品的营收。
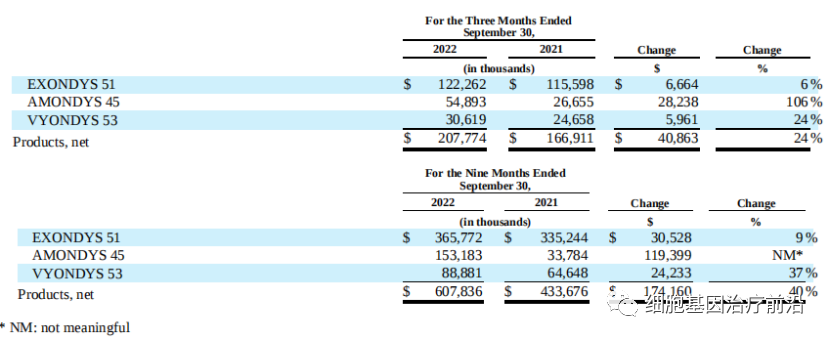
去年前三季度,Sarepta的治疗杜氏肌营养不良(DMD)的三款重磅小核酸药物(Exondys 51、Vyondys 53 和Amondys 45)实现销售额6.08亿美元,同比增长40%。
该三款小核酸药物均用于治疗杜氏肌肉营养不良症( Duchenne Muscular Dystrophy,DMD)。DMD是一种遗传性肌肉萎缩病,其基因存在于X性染色体中( Xp21 ),透过性连锁式隐性遗传型态传播,我国每年约有400-500例DMD患儿出生,累计约7万人确诊为DMD,是世界上该病患者人数最多的国家之一。
- 作为首个获批治疗杜氏肌营养不良症(DMD)的药物,Exondys 51(eteplirsen)于2016年9月FDA获批,它通过与DMD基因的pre-mRNA 51号外显子位置结合,导致在形成成熟mRNA后,51号外显子部分被切除,从而部分修正mRNA读码框,帮助患者合成一些有一定功能形式的相对正常蛋白短一点的抗肌萎缩蛋白,从而改善患者症状。大约有13%的DMD人群可以使用该药物。
- VYONDYS 53(golodirsen)注射液("VYONDYS 53")于2019年12月12日获得FDA批准,用于治疗经检测证实适合使用外显子53跳跃。据悉,该药物仅可用于8%的DMD患者。
- 2021年2月,AMONDYS 45(casimersen)获得FDA批准,用于治疗基因突变外显子45跳跃型的杜氏肌营养不良症患者。这是第一个FDA批准的针对此类基因突变患者的治疗药物,也是近3年以来,FDA加速批准的第三款基于外显子跳跃的反义寡核苷酸疗法。大约8%的DMD患者为外显子45突变。
据药融云统计,eteplirsen这三款小核酸药物2021年在全球售卖了6.12亿美元。其中,eteplirsen销售额最为领先,占了4.54亿美元。
eteplirsen全球销售情况

截图来源:药融云全球药物研发数据库
Sareptaherapeutics公司总裁兼首席执行官Doug Noram表示:“我们很高兴在2022年结束的时候,我们的三种RNA-baseeoMO疗法的执行力非常强,提供的净产品收入预计将超过我们向上修正的指导范围。这些初步结果反映了我们的团队以使命为导向,致力于为近30%的杜氏综合症患者提供服务,这些患者可以接受我们的一种常用疗法。”
Sarepta研发管线
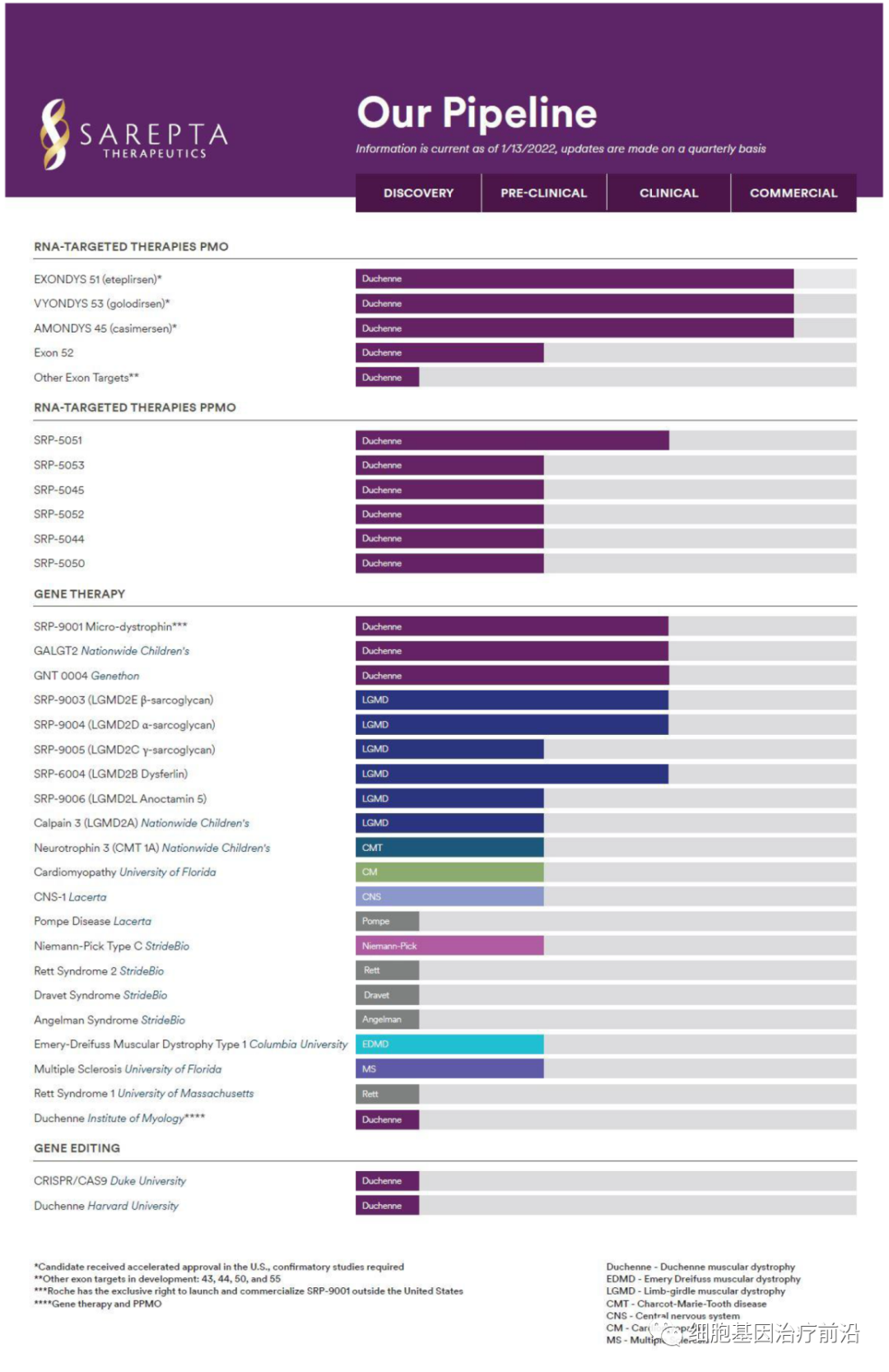
截图来源:Sarepta官网
除了上述三款小核酸药物,SRP-5051与SRP-9001等产品也颇受关注,目前已进入临床阶段。
2022年,12月7日,Sarepta公司公布了SRP-5051的全球第二阶段临床试验。Sarepta在第一代核酸(RNA)药的基础上,增加了药物的细胞吸收能力。
作为eteplirsen的改良版,SRP-5051使用Sarepta公司的肽磷酰胺二聚体(PPMO)技术的新药治疗方法。PPMO技术包括一种专有的细胞穿透肽(peptide),与Sarepta的磷酰胺二聚体( PMO )结合,目的是增加药物在肌肉组织细胞中的吸收。PPMO的特点是将细胞穿透性肽共价连接到PMO上,目的是加强对细胞的输送。SRP-5051被设计用来治疗具有可跳过51号外显子的基因突变的患者的杜氏症。
SRP-5051全球临床试验登记情况
截图来源:药融云全球临床试验数据库
"我们的下一代PPMO技术旨在提高细胞渗透率,旨在为DMD患者提供更便捷的疗效,从而方便他们的跳跃治疗,"Sarepta公司总裁兼首席执行官道格·英格拉姆(Doug Ingram)表示道。
与Sarepta的其他DMD批准药物不同,SRP-9001则是一种基因疗法药物。
SRP-9001是一种研究性基因替代疗法,在去年年底获得了FDA的快速审查,Evaluate Vantage分析师估计SRP-9001能够在2028年实现22亿美元的销售额。
2022年9月29日,罕见病精准遗传医学的领导者Sarepta宣布,已向美国食品药品监督管理局(FDA)提交生物制品许可申请(BLA),申请加速批准SRP-9001用于治疗DMD。
该疗法通过将SRP-9001递送至肌肉组织,用于靶向产生抗肌萎缩蛋白的功能组分。Sarepta负责SRP-9001的全球开发和生产。SRP-9001开发计划由Sarepta Therapeutics 与罗氏合作赞助,并由PPMD提供部分资金。罗氏的全球影响力、商业存在和监管专业知识与Sarepta的杜氏肌基因治疗候选药物相结合,以加速美国以外患者获得SRP-9001。
2020年7月,SRP-9001获得FDA快速通道资格。除快速通道外,SRP-9001还在美国获得了罕见儿科疾病(RPD)认定,并在美国、欧盟、瑞士和日本获得孤儿药资格。
SRP-9001获得的特殊审批
截图来源:药融云全球药物研发数据库
关于Sarepta Therapeutics
作为小核酸药物龙头,Sarepta肩负着一项紧迫的使命:为那些摧毁生命、缩短未来的罕见疾病设计精确的基因药物。公司在杜氏肌营养不良症(Duchenne)和肢带型肌营养不良(LGMD)方面处于领导地位,目前公司有40多个项目处于不同的发展阶段。我们在基因治疗、RNA和基因编辑方面的多平台精确遗传医学引擎驱动着公司庞大的管线。
参考资料:
[1] Sarepta官网https://www.Sarepta.com/
[2] 药融云数据库
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论