
歌礼制药有限公司(香港联交所代码:1672,以下简称“歌礼”)继8月4日宣布,治疗新冠的口服候选药物聚合酶(RdRp)抑制剂ASC10新药临床试验申请已获中国国家药品监督管理局受理后,近日又传来好消息。该公司的口服PD-L1小分子抑制剂前药ASC61用于治疗晚期实体瘤的美国I期临床试验完成首例患者给药。
该临床试验是一项在晚期实体瘤患者中剂量递增的临床试验,旨在评估ASC61的安全性和耐受性,并确定其在标准治疗期间或之后出现疾病进展的晚期实体瘤患者中的最大耐受剂量(MTD)以及Ⅱ期临床试验推荐剂量(RP2D),目前正在内布拉斯加州肿瘤中心及加利福尼亚州肿瘤中心进行,预计将于2023年3月完成。
据药融云数据库显示,ASC61是一款口服PD-L1小分子抑制剂前药,由歌礼制药专有制剂技术开发。其活性代谢物ASC61-A是强效、高选择性的抑制剂,通过诱导PD-L1二聚体的形成和内吞,从而阻断PD-1/PD-L1的相互作用。ASC61单药在人源化小鼠模型等多种动物模型中表现出显著的抗肿瘤疗效。临床前研究显示,ASC61在动物模型中有良好的安全性和药代动力学特征。
ASC61药物基本信息
截图来源:药融云全球药物研发数据库
在一项头对头比较、使用人类PD-L1表达细胞和新鲜外周血单个核细胞(PBMCs)共培养的试验中,ASC61-A治疗可诱导分泌IFNγ且呈现出浓度依赖型,半最大效应浓度EC50为2.86 nM。ASC61-A诱导的IFNγ最大水平与可瑞达(Keytruda)诱导的IFNγ相似。
与PD-1/PD-L1抗体注射剂相比,口服PD-L1抑制剂ASC61具有以下优势:
1)给药方便安全,无需去医院注射,患者依从性更高;
2)容易与其他口服抗肿瘤药物组成全口服联合治疗方案;
3)给药剂量灵活,可以更好地管理免疫相关不良事件;
4)成本相对更低;
5)针对肿瘤组织的渗透性更高。
歌礼制药创始人、董事会主席兼首席执行官吴劲梓博士表示:“免疫原性和肿瘤组织渗透性差是治疗性抗体的主要缺点,会导致PD-1/PD-L1抗体响应率较低。作为一种高度差异化的小分子PD-L1抑制剂,ASC61与抗体相比具有多种优势,且该药在临床前研究中表现出了良好的初步疗效和安全性数据。ASC61在晚期实体瘤中的进展进一步展现了歌礼制药的全球研发能力和执行力。我们期待着进一步推进ASC61临床研究,为晚期肿瘤患者提供更多治疗选择。”

歌礼制药是一家创新研发驱动型生物科技公司,已于香港证券交易所上市(1672.HK),聚焦三大临床需求尚未满足的医疗领域:病毒性疾病、非酒精脂肪肝和肿瘤。歌礼制药目前拥有3个商业化产品:利托那韦片、戈诺卫®和新力莱®,以及20款在研药物。最前沿的候选药物包括ASC22(乙肝功能性治愈)、ASC10和ASC11(口服小分子抗新冠药)、ASC40(复发性胶质母细胞瘤)、ASC42(原发性胆汁性胆管炎)和ASC40(痤疮)。
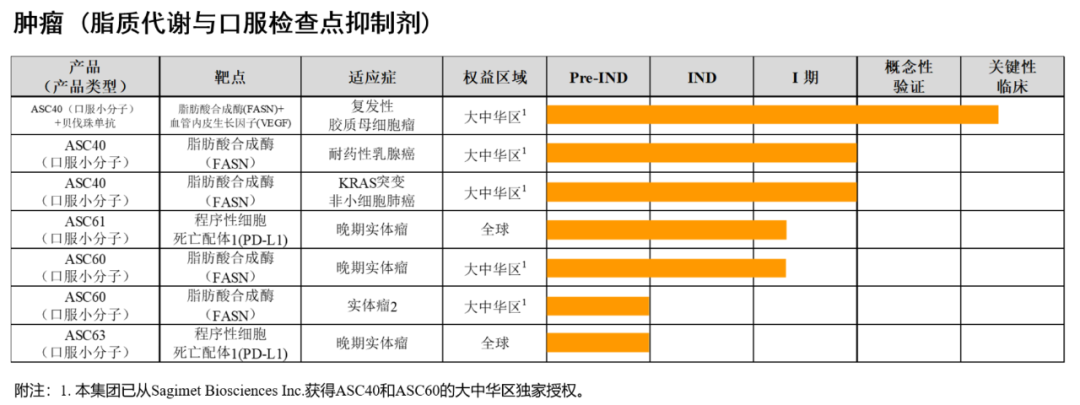
歌礼制药有关肿瘤的研发管线及进展如图所示:
信息参考:
[1] 歌礼制药官网 https://www.ascletis.com/
[2] 药融云数据库
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论