
2021年10月11日,国家药监局发布药品批准证明文件待领取信息,其中包括24个药品通过或视同通过一致性评价。此次过评的药品中,除山西普德药业的注射用奥美拉唑钠是以补充申请方式通过一致性评价,其他药品均按照新注册分类批准之后视同通过一致性评价。
图1:10月11日药品批件信息

数据来源:药融云中国药品审评数据库
药融云一致性评价数据库
新型抗菌药物「注射用头孢他啶阿维巴坦钠」,迎首家过评
注射用头孢他啶阿维巴坦钠,适用于治疗复杂性腹腔内感染(cIAI)、医院获得性肺炎(HAP)和呼吸机相关性肺炎(VAP)、在治疗方案选择有限的成人患者中治疗由下列对本品敏感的革兰阴性菌引起的感染:肺炎克雷伯菌、阴沟肠杆菌、大肠埃希菌、奇异变形杆菌和铜绿假单胞菌等。
图2:“注射用头孢他啶阿维巴坦钠”的适应症

数据来源:药融云药品说明书数据库
根据药融云数据显示,注射用头孢他啶阿维巴坦钠(商品名:思福妥)为独家品种,是由阿斯利康和Forest Laboratories共同研发。辉瑞公司于2016年12月正式收购阿斯利康旗下的小分子抗生素业务,除在美国和加拿大的商业化权外,辉瑞在全球拥有研发、上市和商业推广销售的权利。2019年5月21日获得国家药品监督管理局批准在国内上市销售。
表3:“注射用头孢他啶阿维巴坦钠”的批文信息

数据来源:药融云中国药品批文数据库
截止目前为止,只有齐鲁制药一家企业按照新注册分类批准之后视同通过一致性评价,为该品种首家。2019年11月,齐鲁制药提交注射用头孢他啶阿维巴坦钠的上市申请,进入cde药审中心被承办,历时六百多天,获药监局批准生产,并视同通过一致性评价。
图4:该品种的一致性审评信息

数据来源:药融云中国药品审评数据库
从2019年注射用头孢他啶阿维巴坦钠获得国家药品监督管理局批准,便在国内上市销售。根据药融云全国医院销售数据显示,2020年的销售额超1.5亿;2021年,该药品的前两个季度的销售额已超过1.5亿,全年销售额有望赶超2020年。
图5:“吡嗪酰胺片”的销售额占比
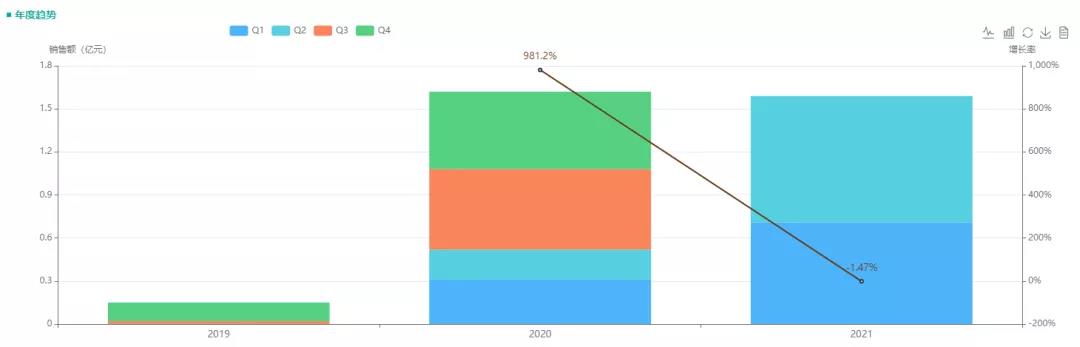
数据来源:药融云全国医院销售数据库
齐鲁制药过评药品超80品种,累计38款首家
根据药融云一致性评价数据库显示,截止目前齐鲁制药(包括:齐鲁制药有限公司和齐鲁制药(海南)有限公司)已有上百个品规通过(含视同通过)一致性评价,其中包括38个首家品种。在过评的首家品种中,片剂最多(包括吉非替尼片、阿德福韦酯片和马来酸伊索拉定片等),占总数的52%;其中治疗领域过评最多的为抗肿瘤药和免疫机能调节药、系统用抗感染药和消化系统与代谢药等。
表1:“齐鲁制药”首家过评药品汇总
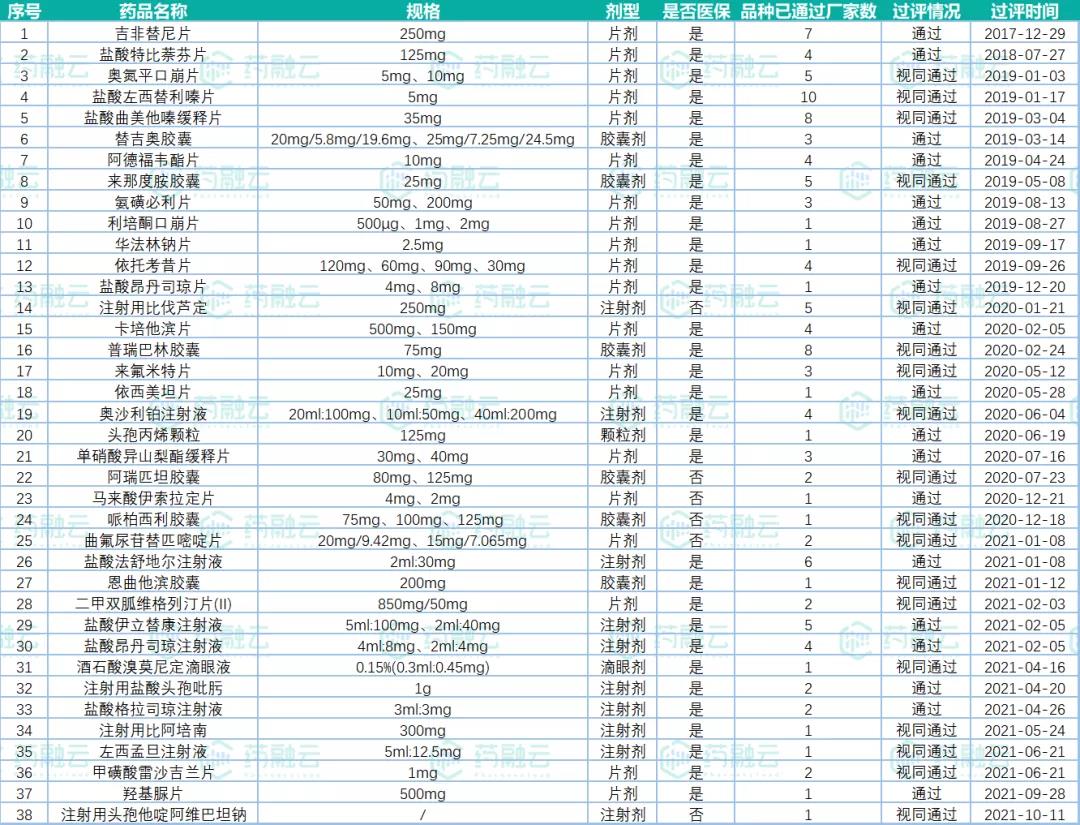
图片数据来源:药融云一致性评价数据库
—END—
本文为原创稿件,未经授权请勿转载。


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)













 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论