备受瞩目Remdesivir(瑞德西韦),今日揭晓了三项临床试验结果。
美国国家过敏与传染病研究所NIAID和吉利德(Gilead)以及国际顶级权威医学期刊《柳叶刀》先后发布了三项关于瑞德西韦的不同临床试验的报告。
一、NIAID:显著缩短恢复时间
美国国家过敏与传染病研究所(National Institute of Allergy and Infectious Diseases ,NIAID)发表公告,认为瑞德西韦在一项随机双盲对照试验中显示出了疗效。
NIAID主任Dr. Fauci在白宫接受采访表示Remdesivir治疗COVID-19明显缩短病人恢复时间(clear cut positive effect in diminishing time to recover)。并表示Remdesivir将成为COVID-19标准治疗。
该试验共招募了来自全球多个国家的1063名进展期或有肺炎表现的患者入组,初步数据分析结果表明,接受Remdesivir治疗的患者平均恢复时间为11天,然而对照组恢复时间为15天。痊愈时间缩短了31%。同时,Remdesvir可以抑制病毒。然而目前看来Remdesivir只轻微改善了病死率(8%:11%)。

二、吉利德:5天疗程与10天疗程效果相当
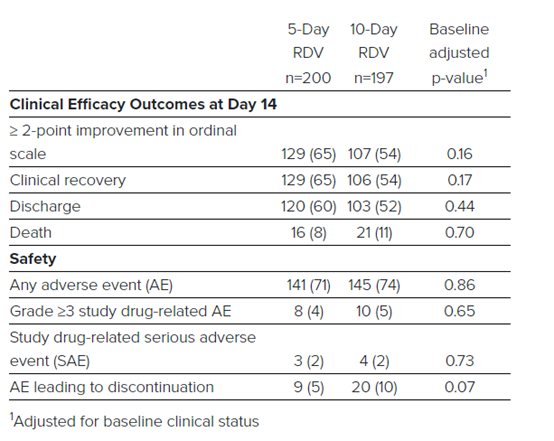
吉利德公司宣布了Remdesivir治疗COVID-19的5天疗程和5天疗程天临床试验结果。该试验397名重症入组,没有安慰剂对照组,与NIAID试验互补。研究发现5天疗程组和10天疗程组疗效没有显著差异,研究显示5天疗程组患者接受治疗后50% 10天后恢复,10天疗程组患者50% 11天后恢复。治疗第14天,5天疗程组患者64.5%痊愈;10天疗程组患者53.8%痊愈。
研究进一步分析了发病10天内接受Remdesivir和发病10天后接受Remdesivir的结果。治疗后第14天,62%在发病10天内接受治疗的患者出院。49%在发病10天以上接受治疗的患者出院。
吉利德首席医学官Merdad Parsey博士表示:部分患者可能需要接受5天的治疗方案,这将显著缩短临床病程,在大流行的情况下,这一点尤其重要,以帮助医院和医护人员治疗更多急需护理的患者。”
关键疗效和安全性数据详见下表:
三、中国试验结果:未见显著临床改善
顶尖医学杂志《柳叶刀》发表了曹彬、王辰团队关于瑞德西韦在中国的临床结果,为上周WHO提前泄露了的临床试验结果,该项试验237名患者入组,为针对重症患者的随机、双盲、安慰剂对照的多中心临床试验,有158名患者接受了10天的瑞德西韦治疗,其余78人则使用安慰剂治疗,结果初步却显示瑞德西韦治疗重症患者未见显著临床改善。
研究认为虽然没有统计学差异,但是接受10天Remdesivir治疗的患者临床恢复更快。28天Remdesivir组病死率为14%,对照组为13%(这个重症对照组病死率比自然队列都要低,这是很多人质疑的地方)。28天临床表现改善率,Remdesvir为65%(与Gilead临床试验相似),对照组为58%。Remdesivir治疗大大减少病人使用呼吸机时间(7天:15.5天)。但与对照组相比,Remdesivir不能有效降低接受其治疗患者的病毒载量。
NIAID 和中国临床试验结果结论有很高的一致性:Remdesivir不降低病死率,但是可能缩短病程,接受治疗患者痊愈时间更快。但NIAID试验入组人数为1063,中国试验为237(而后因为入组人数少而终止),因此NIAID得试验结果更有参考价值。
参考来源:
1、https://www.gilead.com/news-and-press/press-room/press-releases/2020/4/gilead-announces-results-from-phase-3-trial-of-investigational-antiviral-remdesivir-in-patients-with-severe-covid-19
2、NIH Clinical Trial Shows Remdesivir Accelerates Recovery from Advanced COVID-19. Retrieved April 29, 2020
3、https://www.thelancet.com/journals/lancet/article/PIIS0140-6736%2820%2931022-9/fulltext#
4、https://m.weibo.cn/1251560221/4499228075139439












收藏
登录后参与评论