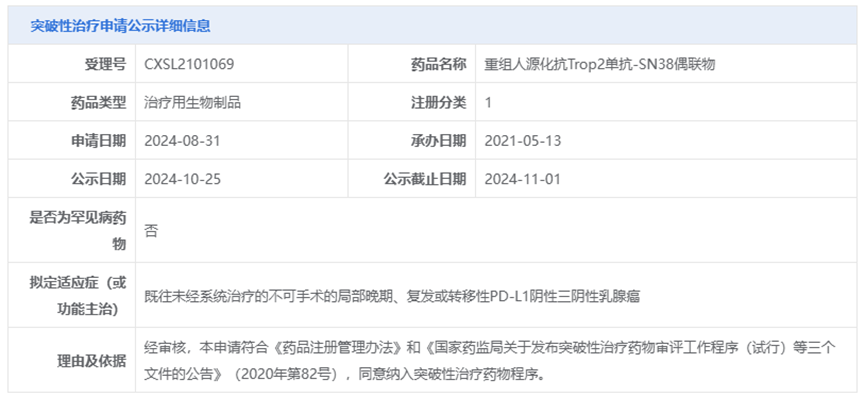
2024年11月02日,据中国国家药监局药品审评中心(CDE)官网公示,诗健生物核心产品ESG401(重组人源化抗Trop2单抗-SN38偶联物)纳入突破性治疗品种,拟定适应症为——既往未经系统治疗的不可手术的局部晚期、复发或转移性PD-L1阴性三阴性乳腺癌。
ESG401是诗健生物首个临床阶段在研的ADC,由拓扑异构酶I抑制剂SN-38通过稳定的可切割连接子与人源化Trop2 IgG1单克隆抗体偶联,药物抗体偶联比(DAR)为8。临床研究数据提示,ESG401耐受剂量远高于同靶点其他ADC,脱靶毒性和在靶毒性发生率低,程度轻,有明显的安全性优势。
本次ESG401纳入突破性治疗品种的适应症为“既往未经系统治疗的不可手术的局部晚期、复发或转移性PD-L1阴性三阴性乳腺癌(TNBC)”。
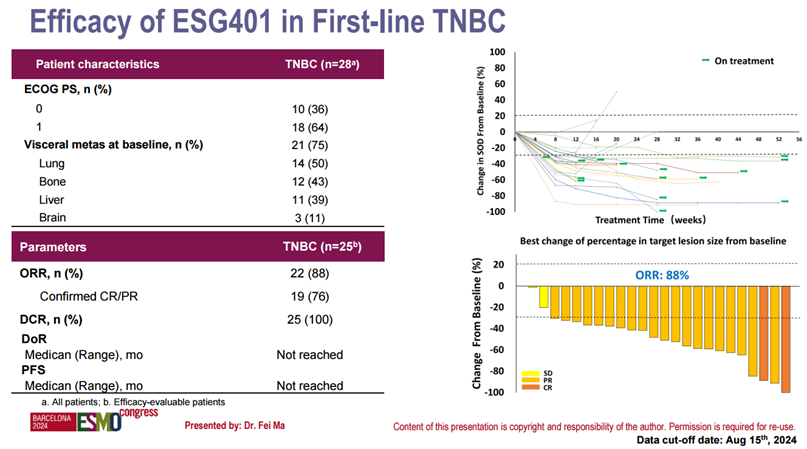
在今年9月召开的2024年欧洲肿瘤内科学会(ESMO)年会上,中国医学科学院马飞教授进行了两场关于ESG401临床研究结果的简短口头报告,其中一场报告即包括了ESG401在一线治疗转移性三阴性乳腺癌(mTNBC)患者队列中的阶段性结果:截至2024年8月15日,ESG401一线治疗mTNBC患者队列中疗效可评估的受试者共25例,2例患者达到完全缓解(CR),20例患者疗效评价为部分缓解(PR),ORR达到88%;DCR为100%。值得注意的是,在该队列中共入组了3例脑转移患者,其中有2例患者颅内转移病灶达到完全缓解(IC-CR),另1例患者的颅内转移病灶达到了部分缓解(IC-PR),颅内疾病控制率(IC-DCR)也达到了100%。
在2024年ESMO年会上的另一场报告中,展示了ESG401在基线伴有脑转移的HER2阴性乳腺癌患者中的安全性和有效性数据。这项分析总共纳入了21例基线伴有脑转移的晚期乳腺癌患者,其中三阴性乳腺癌占67%,HR+/HER2-乳腺癌占33%。脑病灶最大者达到21mm。初步研究结果显示,在接受ESG401治疗后的17例疗效可评估的患者中,有3例患者的颅内病灶达到完全缓解(CR),4例患者达到部分缓解(PR),颅内客观响应率(IC-ORR)达到41%,疾病控制率(IC-DCR)达到76%。这些患者的总体疗效响应也与颅内响应表现一致,总体客观响应率(ORR)为53%,总体疾病控制率(DCR)为71%。同时,ESG401在脑转移患者中的安全性表现也与总体人群保持一致。


此前,ESG401针对“既往接受过至少一线系统性化疗的HR+/HER2-转移性乳腺癌”适应症已经获得监管机构批准,进入关键注册性3期临床试验阶段,并于2024年7月完成首例入组。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论