
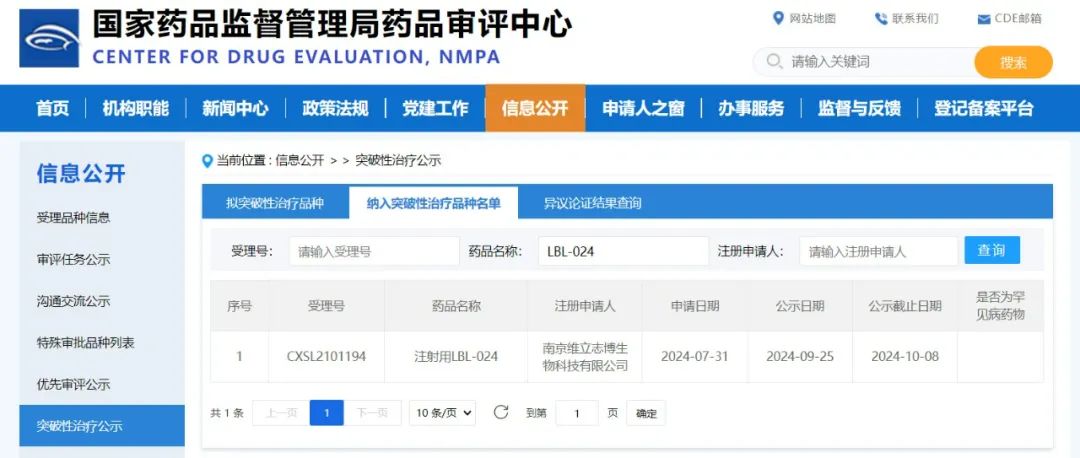
来源:CDE官网
突破性治疗药物是指用于防治严重危及生命或者严重影响生存质量的疾病,且尚无有效防治手段,或者与现有治疗手段相比有足够证据表明具有明显临床优势的创新药或改良型药物。2012年7月,美国食品药品监督管理局(FDA)继快速通道、加速批准、优先审评之后,首创了“突破性疗法”的审评工作程序,通过加速审批流程和提供更加密切的协作和指导,为具有重大临床潜力的新药提供了一种快速发展和获得市场准入的途径。据FDA突破性疗法的历史数据,获批品种可平均缩短约2.5年的上市周期。
2020年7月, CDE发布《突破性治疗药物审评工作程序(试行)》,突破性疗法正式在中国问世,创新药与改良型新药研发企业可在不晚于III期临床开展前申请突破性治疗药物认定,CDE将优先对授予突破性治疗的药物配置资源,加快市场亟待需要的药物上市。CDE认定的突破性治疗药物享有多重政策优势,同时也有非常严格的审评标准,申请药物必须在早期研究中显示出良好的前景,并提供初步临床数据证明与现有治疗相比,该药物在临床上有意义的终点方面有实质性改善。可见突破性疗法是含金量极高的称谓,也预示着该药物较高的上市可能性。
维立志博首席医学官 蔡胜利博士 表示:
据历年药品审评报告数据显示,有资格申请突破性治疗药物认定的品种已是少数,而能够获批的品种更是凤毛麟角。LBL-024获突破性治疗药物认定是维立志博研发实力的又一有力证明,也是维立志博坚持面向全球市场专注First-in-class产品研发战略的一次重大胜利,将大大推进这个创新药物的开发进程,早日为EP-NEC患者带来更有效的治疗选择。
维立志博创始人、董事长、CEO康小强博士表示:
CDE认定的突破性治疗药物倾向于关注更优秀的临床数据、更差异化的临床靶点、更具确定性的疗法,是目前中国药监体系门槛和含金量极高的资质称谓,也是探寻有价值新药项目的最高切入点。本次LBL-024获得突破性治疗药物认定,也体现了监管部门对于LBL-024能够改变这类患者无药可用的困境、改善这类患者生存的信心。维立志博一贯坚持差异化创新,期待LBL-024早日上市,成为继PD-1/PD-L1、CTLA-4、LAG-3后又一免疫治疗全新靶点药物。
 关于维立志博
关于维立志博MORE
热点资讯





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论